题目内容
某无色透明的溶液,一定能大量共存的离子组是( )
| A.Cl-、SO42-、Na+、K+ | B.K+、CO32-、Ca2+、NO3- |
| C.HCO3-、Na+、NO3-、H+ | D.NO3-、Cu2+、Cl-、NH4+ |
A
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以共存。B中CO32-和Ca2+反应,不能大量共存;C中HCO3-和H+反应,不能大量共存;D中铜离子是蓝色的,不符合题意;A中各离子互不反应,故答案选A。
考点:本题考查离子共存。

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是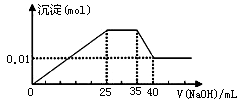
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
| D.实验所加的NaOH的浓度为2mol·L-1 |
下列表示对应化学反应的离子方程式正确的是
| A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O |
下列指定溶液中,各组离子可能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B.在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C.在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D.由水电离的c(H+)=10-13mol·L-1的溶液中:Mg2+、Cl-、K+、SO42- |
下列物质属于电解质的一组是( )
| A.CO2、NH3、HCl | B.H2SO4、HNO3、BaCl2 |
| C.H3PO4、H2O、Cu | D.液态KNO3、NaOH溶液、C2H5OH |
下列物质中属于强电解质的是
| A.NH3·H2O | B.NaCl溶液 | C.CH3COOH | D.BaSO4 |
下列离子方程式中正确的是( )
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O =SO32-+2HClO |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl- |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2+ +2OH-= BaSO4↓+2H2O |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O |
下列对某些问题的认识正确的是
| A.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B.SO32-、ClO-、NO3-三种酸根离子在溶液中能大量共存 |
| C.不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
| D.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
在水溶液中能够大量共存的离子组是
| A.NH4+、Na+、CO32—、Cl— | B.K+、Fe3+、OH—、SO42— |
| C.Na+、Al3+、HCO3—、NO3— | D.H+、Cu2+、S2—、SO42— |