题目内容
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是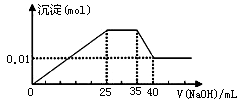
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
| D.实验所加的NaOH的浓度为2mol·L-1 |
B
解析试题分析:溶液是无色的,因此一定不存在铜离子。第一份加足量AgNO3溶液后,有白色沉淀产生,这说明溶液中至少含有CO32-、SO42-中的一种。第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。则该办事处是硫酸钡或碳酸钡或是二者的混合物。第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据图像可知,开始立即出现沉淀,这说明不存在大量的氢离子。当沉淀达到最大值时保持不变,这说明加入的氢氧化钠与溶液中的NH4+反应生成一水合氨,因此一定含有NH4+。继续加入氢氧化钠溶液,沉淀开始减少,但不完全消失。这说明沉淀应该是氢氧化镁和氢氧化铝的混合物,所以溶液中一定含有Mg2+、Al3+,则一定不存在CO32-,所以一定还含有SO42-。A、原溶液一定不存在H+、Cu2+、CO32-,A正确;B、硫酸钡的质量是6.99g,物质的量=6.99g÷233g/mol=0.03mol。根据图像可知,氢氧化镁的物质的量是0.01mol,则此时氢氧化镁消耗的氢氧化钠应该是0.02mol。溶解氢氧化铝消耗的氢氧化钠溶液体积是5ml,则产生氢氧化铝消耗的氢氧化钠溶液体积15ml。所以产生氢氧化镁消耗的氢氧化钠溶液体积是10mol,所以根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知,氢氧化镁与氢氧化铝的物质的量相等,都是0.01mol。与NH4+反应的氢氧化钠溶液体积是10ml,所以NH4+的物质的量是0.02mol。根据溶液的电中性可知,溶液中阴离子SO42-的电荷数是0.06mol,而阳离子 的电荷数是0.02mol+0.03mol+0.02mol=0.07mol,所以溶液中一定还含有NO3-,但不能确定原溶液是否含有K+,B不正确;C、原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2,C正确;D、实验所加的NaOH的浓度为0.02mol÷0.01L=2mol·L-1,D正确,答案选B。
考点:考查离子共存、离子检验的有关判断和计算

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案下列物质的水溶液能导电,但属于非电解质的是
| A.H2SO4 | B.Cl2 | C.NaAlO2 | D.SO2 |
下列各组离子能够大量共存的是( )
| A.pH=0的溶液中:Fe3+、Mg2+、Cl—、SO42— |
| B.使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3—、SO42— |
| C.滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32—、NO3— |
| D.水电离出的c(H+)=1×10—13mol·L—1的溶液中:K+、HCO3—、Cl—、NH4+ |
下列各反应对应的离子方程式正确的是
| A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 → HCO3- |
| B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- → CaCO3↓+ CO32-+ 2H2O |
| C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 → 2Fe3++6Cl-+2Br2 |
| D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-→ BaSO4↓+H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在0.1 mol·L-1 NaOH溶液中:K+、Na+、SO42-、HCO3- |
| B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、Ba2+、NO3-、Cl- |
| C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN- |
| D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-(还原性SO32-大于I-),向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-。
| A.①③ | B.①②③ | C.①② | D.②③④ |
甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH—、NO3—、SO42— |
取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是
A.甲中一定含Na+ B.乙中一定含NH4+
C.丙中一定含Mg2+ D.丙中一定含SO42—
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是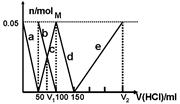
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓ |
某无色透明的溶液,一定能大量共存的离子组是( )
| A.Cl-、SO42-、Na+、K+ | B.K+、CO32-、Ca2+、NO3- |
| C.HCO3-、Na+、NO3-、H+ | D.NO3-、Cu2+、Cl-、NH4+ |