题目内容
【题目】铋酸钠是一种化学物质,浅黄色或褐色的无定形粉末,不溶于水,常用于锰离子的检验,其有一种制备流程如图:
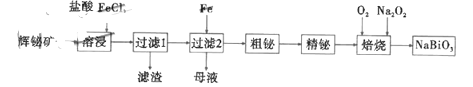
已知:a.辉铋矿(主要成分是![]() ,还含少量
,还含少量![]() 等杂质);
等杂质);
b.水解能力:![]() 。
。
回答下列问题:
(1)制备流程中,溶浸时加入过量的浓盐酸的作用是__________________________。
(2)溶浸时,为了提高浸取速率,可以采取的措施是_____________(填序号)。
a.加入足量的蒸馏水
b.搅拌
c.粉碎矿石
d.升髙温度
(3)过滤2所得“母液”中经过通入气体![]() 后可再循环利用,气体
后可再循环利用,气体![]() 最好是__________(填化学式)。
最好是__________(填化学式)。
(4)写出焙烧时生成铋酸钠的化学方程式:__________________________________,当消耗标准状况下![]() 时,转移电子的数目是________________。
时,转移电子的数目是________________。
(5)铋酸钠(![]() )可用于锰离子(
)可用于锰离子(![]() )的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰
)的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰![]() 的混合溶液中并加热,可得紫色溶液(
的混合溶液中并加热,可得紫色溶液(![]() 无色),此反应的离子方程式为_________。
无色),此反应的离子方程式为_________。
(6)25℃时,向浓度均为![]() 的
的![]() 、
、![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液(设溶液体积变化不计),当
溶液(设溶液体积变化不计),当![]() 开始沉淀时,所得悬浊液中
开始沉淀时,所得悬浊液中![]() _________。[已知:
_________。[已知:![]()
![]() 、
、![]() 、
、![]() ]
]
【答案】溶解矿物质;防止![]() 水解 bcd Cl2
水解 bcd Cl2 ![]()
![]()
![]()
![]()
【解析】
先将辉铋矿用酸溶解,在该过程中注意金属离子的水解,在该过程中,二氧化硅不溶解,以沉淀形式除去,后加铁置换出粗铋,溶液中的亚铁离子被氧化为三价即能循环使用,粗铋精炼后,再与氧气、过氧化钠在一定温度下得到铋酸钠。
(1)制备流程中,酸可以溶解铁矿物,溶解的金属离子会水解产生氢离子,故加浓酸可以抑制金属离子的水解;
(2)提高反应速率,可以增大反应物的浓度,该处是固体物质,故可以粉碎矿物,增大接触面积,升高温度也能提高反应速率;
故答案为:bcd;
(3)过滤2所得“母液”中通入气体![]() 后可再循环利用,发生反应:2FeCl2+Cl2=2FeCl3;
后可再循环利用,发生反应:2FeCl2+Cl2=2FeCl3;
故答案为:Cl2;
(4)焙烧时加入了氧气与过氧化钠,反应物还有粗铋,反应后生成铋酸钠,根据电子得失守恒,得出化学方程式为:![]() ;消耗标准状况下
;消耗标准状况下![]() 时,即消耗氧气的物质的量为:
时,即消耗氧气的物质的量为:![]() ,根据方程式可得,氧气与转移电子的关系式为:
,根据方程式可得,氧气与转移电子的关系式为:![]() ,则转移电子的数目为:
,则转移电子的数目为:![]() ;
;
(5)将铋酸钠固体加入到足量稀硫酸和硫酸锰![]() 的混合溶液中并加热,可得紫色溶液(
的混合溶液中并加热,可得紫色溶液(![]() 无色),则有高锰酸根生成,根据配平原则(得失电子守恒)可得此反应的离子方程式为:
无色),则有高锰酸根生成,根据配平原则(得失电子守恒)可得此反应的离子方程式为:![]() ;
;
(6)25℃时,向浓度均为![]() 的
的![]() 、
、![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液(设溶液体积变化不计),已知:
溶液(设溶液体积变化不计),已知: ![]() 、
、![]() ,硫化铁、硫化铅均是AB型沉淀,故悬浊液中
,硫化铁、硫化铅均是AB型沉淀,故悬浊液中![]() 之比即二者的沉淀平衡常数之比,
之比即二者的沉淀平衡常数之比,![]() 。
。