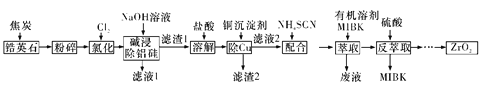
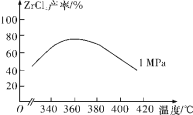
题目内容
【题目】某化学兴趣小组设计了一系列实验,根据具体实验回答下列问题:
Ⅰ.制取![]()
化学反应方程式为![]() 。
。
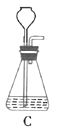
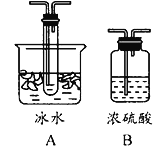
(1)根据实验需要,下列![]() 装置中___________(填序号)最适合制备
装置中___________(填序号)最适合制备![]() 。
。
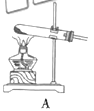
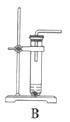

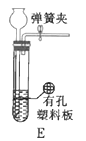
(2)在实验中发现,![]() 气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
Ⅱ.制取![]() 、
、![]() 混合气体并验证(实验装置如图所示)
混合气体并验证(实验装置如图所示)
化学反应方程式为![]() 。
。
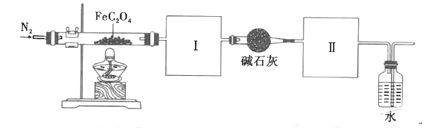
(3)根据实验需要,请从下列![]() 装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。
装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。
Ⅲ.测定样品中![]() 的含量
的含量
(4)某草酸亚铁样品中含有少量硫酸亚铁,设计用滴定法测定该样品中![]() 的含量,滴定反应为
的含量,滴定反应为![]() 。
。
实验方案设计如下:
①将准确称量的ag草酸亚铁样品置于![]() 锥形瓶内,加入适量
锥形瓶内,加入适量![]() 的
的![]() 溶解,加热至70℃左右,立即用浓度为
溶解,加热至70℃左右,立即用浓度为![]() 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液![]() 。
。
②向上述滴定混合液中加入适量的![]() 粉和过量的
粉和过量的![]() 的
的![]() 溶液,煮沸(不含
溶液,煮沸(不含![]() ),继续用
),继续用![]() 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液![]() 。回答下列问题:
。回答下列问题:
步骤②中检验溶液不含![]() 的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含
的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含![]() 。计算
。计算![]() (
(![]() 的摩尔质量为
的摩尔质量为![]() )的质量分数为__________%。(用含
)的质量分数为__________%。(用含![]() 的式子表示)
的式子表示)
【答案】D 浓硫酸的浓度过低 ![]() 变质 C E 收集一氧化碳,防止污染空气 KSCN溶液 无明显现象或溶液不变红
变质 C E 收集一氧化碳,防止污染空气 KSCN溶液 无明显现象或溶液不变红 ![]()
【解析】
Ⅰ制取![]() :该反应是固液混合不加热型;反应速率过慢,装置气密性没有问题,则是反应物本身的问题;Ⅱ制取
:该反应是固液混合不加热型;反应速率过慢,装置气密性没有问题,则是反应物本身的问题;Ⅱ制取![]() 、
、![]() 混合气体并验证:先通氮气,排除装置内的空气,产生的气体先通过澄清石灰水检验
混合气体并验证:先通氮气,排除装置内的空气,产生的气体先通过澄清石灰水检验![]() ,碱石灰除去CO2并干燥气体,再通过CO浓度仪则可检验,最后的水是收集
,碱石灰除去CO2并干燥气体,再通过CO浓度仪则可检验,最后的水是收集![]() ,防止污染空气;Ⅲ测定样品中
,防止污染空气;Ⅲ测定样品中![]() 的含量:某草酸亚铁样品中含有少量硫酸亚铁,故测定该样品中
的含量:某草酸亚铁样品中含有少量硫酸亚铁,故测定该样品中![]() 的含量,需要根据
的含量,需要根据![]() 的消耗量来计算,
的消耗量来计算,![]() 、
、![]() 均会被高锰酸钾氧化,实验②中无
均会被高锰酸钾氧化,实验②中无![]() ,则实验①是
,则实验①是![]() 与
与![]() 反应,反应②是
反应,反应②是![]() 与
与![]() 反应,再根据高锰酸钾的消耗量与
反应,再根据高锰酸钾的消耗量与![]() 的关系式求解。
的关系式求解。
(1)制取![]() 的方程式:
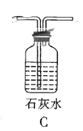
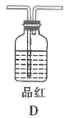
的方程式: ![]() ,该反应属于固液混合不加热型,最佳反应装置为D;
,该反应属于固液混合不加热型,最佳反应装置为D;
故答案为:D;
(2)在实验中发现,![]() 气体产生缓慢,但又不存在气密性问题,故是反应物本身的问题,可能是浓硫酸的浓度过低或
气体产生缓慢,但又不存在气密性问题,故是反应物本身的问题,可能是浓硫酸的浓度过低或![]() 变质;
变质;
故答案为:浓硫酸的浓度过低;![]() 变质;
变质;
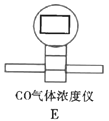
(3)先通氮气,排除装置内的空气,产生的气体先通过澄清石灰水检验![]() ,碱石灰除去CO2并干燥气体,再通过CO浓度仪则可检验,最后的水是收集
,碱石灰除去CO2并干燥气体,再通过CO浓度仪则可检验,最后的水是收集![]() ,防止污染空气;
,防止污染空气;
故答案为:C;E;收集CO,防止污染空气;
(4)检验溶液是否含![]() ,可取1滴煮沸后的溶液滴入KSCN溶液中,观察溶液是否变血红色,此处是不含
,可取1滴煮沸后的溶液滴入KSCN溶液中,观察溶液是否变血红色,此处是不含![]() ,故无明显变化;根据氧化还原反应可知:
,故无明显变化;根据氧化还原反应可知:![]() ,实验②中无
,实验②中无![]() ,则实验①是
,则实验①是![]() 与
与![]() 反应,反应②是
反应,反应②是![]() 与
与![]() 反应,根据实验①来计算:
反应,根据实验①来计算:![]() ,则对应消耗的
,则对应消耗的![]() 为:
为:![]() ,故
,故![]() (
(![]() 的摩尔质量为
的摩尔质量为![]() )的质量分数=
)的质量分数=![]() ;
;
故答案为:KSCN溶液;无明显现象或溶液不变红;![]() 。
。