题目内容
(16分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=" -574" kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=" -1160" kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。

III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。

①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=" -574" kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=" -1160" kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。

III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。

①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
28.(16分)Ⅰ、 CH4(g)+2NO2(g) = N2(g) + CO2(g) +2H2O(l) ⊿H=" -955" kJ·mol-1(2分)
Ⅱ、(1)①K="0.25" (2分) ② > (1分)
(2)①升温(1分)增压(1分)(其他合理答案参照给分)
②如右图(2分)
Ⅲ、① 2MnO2 + O2 + 4KOH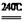 2K2MnO4 + 2H2O(2分)
2K2MnO4 + 2H2O(2分)
大于2 : 1 (1分)
② MnO42- - e- = MnO4- (2分)
③ H2(1分) KOH固体 (1分)
Ⅱ、(1)①K="0.25" (2分) ② > (1分)
(2)①升温(1分)增压(1分)(其他合理答案参照给分)
②如右图(2分)
Ⅲ、① 2MnO2 + O2 + 4KOH
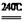 2K2MnO4 + 2H2O(2分)
2K2MnO4 + 2H2O(2分)大于2 : 1 (1分)
② MnO42- - e- = MnO4- (2分)
③ H2(1分) KOH固体 (1分)
试题分析:Ⅰ:(1)将方程式(①+②+③×4)/2得CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O的方程式,故△H=(-574 -1160-44.0×4)/2= -955 kJ·mol-1;Ⅱ:(1)①A点时CO的转化率为50%,转化量为5mol,故平衡时CO、H2、CH3CH2OH、H2O的物质的量分别为5mol、10mol、2.5mol、2.5mol,平衡浓度分别为0.5mol/L、1mol/L、0.25mol/L、0.25mol/L,代入平衡常数表达式K=
 =0.25;②C点的温度高,反应速率快,达到平衡所用的时间短;(2)①曲线Ⅰ和实线相比较,加快了反应速率,平衡向左移动了,故为升高温度;虚线Ⅱ和实线相比较,反应速率加快,平衡向右移动了,故为加压;②甲醇的物质的量从零开始逐渐增大,达到平衡状态时氢气消耗6mol,生成甲醇2mol,以后甲醇的物质的量不再发生变化了;Ⅲ①由题目信息可得通过二氧化锰和KOH、氧气在熔融条件下生成K2MnO4,结合原子守恒和氧化还原方程式的配平方法写出化学方程式;当KOH和二氧化锰之比为2:1时恰好完全反应,当在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4,需保持碱性环境,故两者物质的量之比大于2:1;②阳极MnO42-失去电子发生氧化反应生成MnO4- ,故为MnO42- - e- = MnO4- ;③阴极氢离子得电子生成氢气,同时生成氢氧化钾,氢氧化钾可以循环使用。
=0.25;②C点的温度高,反应速率快,达到平衡所用的时间短;(2)①曲线Ⅰ和实线相比较,加快了反应速率,平衡向左移动了,故为升高温度;虚线Ⅱ和实线相比较,反应速率加快,平衡向右移动了,故为加压;②甲醇的物质的量从零开始逐渐增大,达到平衡状态时氢气消耗6mol,生成甲醇2mol,以后甲醇的物质的量不再发生变化了;Ⅲ①由题目信息可得通过二氧化锰和KOH、氧气在熔融条件下生成K2MnO4,结合原子守恒和氧化还原方程式的配平方法写出化学方程式;当KOH和二氧化锰之比为2:1时恰好完全反应,当在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4,需保持碱性环境,故两者物质的量之比大于2:1;②阳极MnO42-失去电子发生氧化反应生成MnO4- ,故为MnO42- - e- = MnO4- ;③阴极氢离子得电子生成氢气,同时生成氢氧化钾,氢氧化钾可以循环使用。
练习册系列答案
相关题目
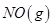 和足量
和足量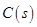 ,发生反应
,发生反应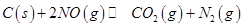 ,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是
,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是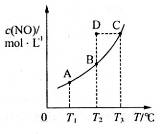
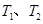 时的平衡常数分别为
时的平衡常数分别为 ,则
,则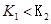
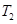 时,若反应体系处于状态D,则这时一定有
时,若反应体系处于状态D,则这时一定有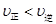
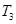 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态
时,若混合气体的密度不再变化,则可以判断反应达到平衡状态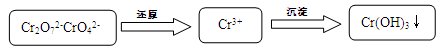
 Cr2O72- + H2O
Cr2O72- + H2O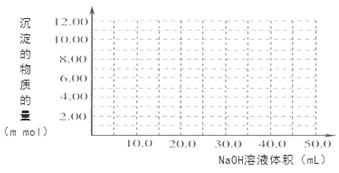
 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1
4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1
4NO2(g)+O2(g) ΔH=+d kJ·mol-1 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态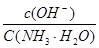 增大
增大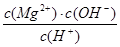 不变
不变 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2 3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )