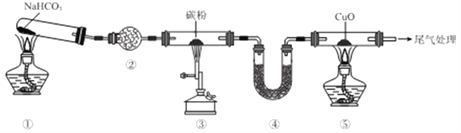
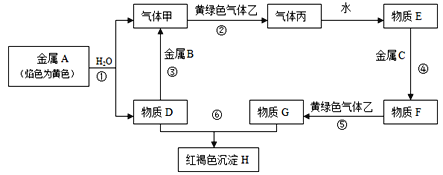
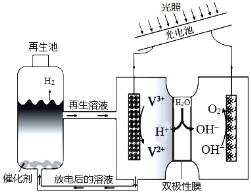
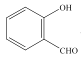
题目内容
【题目】有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
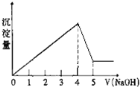
A. 1:1B. 2:1C. 3:1D. 1:2
【答案】D
【解析】
氢氧化钠的体积为0~4时,发生的反应有:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,氢氧化钠的体积为4~5时发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,假设氢氧化铝溶解消耗氢氧化钠为1mol,则沉淀最大时消耗NaOH为4mol,结合方程式计算n[Al(OH)3],进而计算n[Mg(OH)2],由原子守恒知n(A1)=n[Al(OH)3],n(Mg)=n[Mg(OH)2].
氢氢化钠的体积为0~4时,发生的反应有:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,氢氢化钠的体积为4~5时,发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,假设氢氢化铝溶解消耗氢氢化钠为1mol,则沉淀最大时消耗NaOH为4mol,由Al(OH)3+NaOH=NaAlO2+2H2O可知,n [Al(OH)3]=n[NaOH]=1mol ,根据Al3++3OH-=Al(OH)3↓知生成氢氢化镁沉淀消耗NaOH为4mol-3mol=1mol,由Mg2++2OH-=Mg(OH)2↓,可知[Mg(OH)2]=0.5mol,由原子守恒知n(A1)=n[Al(OH)3]=1mol,n(Mg)=n[Mg(OH)2]=0.5mol,故原合金中镁、铝物质的量之比为0.5mol:1mol=1:2,故本题选D。

【题目】某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某化学兴趣小组为验证该氧化物粉末的组成,做了如下实验:
(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成
编号 | 实验操作 | 实验现象与结论 |
① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
② | 将①中所得溶液分成两份,向其中一份滴加几滴__________,振荡 | 若溶液________ ,说明有Fe2O3存在 |
③ | 向另一份溶液中加入少量__________,振荡 | 若溶液________ ,说明有FeO存在 |
(2)乙同学称取30.4g固体,按以下步骤进行实验:
步骤一 将固体置于烧杯中,加入1mol/L的硫酸将固体完全溶解
步骤二 往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液
步骤三 将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体
①步骤二中加入氯水的目的是__________________________________________;
②步骤三中沉淀洗涤的操作为__________________________________________;
③原固体中FeO和Fe2O3的物质的量之比为___________________。