题目内容
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 1mol甲基含10NA个电子
B. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA
C. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA
D. 15 g C2H6中含有共价键数目为3NA
【答案】C
【解析】
A、甲基不带电荷,一个甲基含9个电子,故1mol甲基中含9NA个电子,故A错误;
B、标准状况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故B错误;
C、苯和苯乙烯的最简式均为CH,故2.6g混合物中含有的CH的物质的量为![]() =0.2mol,完全燃烧消耗O2的物质的量=0.2mol×(1+
=0.2mol,完全燃烧消耗O2的物质的量=0.2mol×(1+![]() )=0.25mol,消耗O2的分子数为0.25NA,故C正确;
)=0.25mol,消耗O2的分子数为0.25NA,故C正确;
D.1mol乙烷分子中含有6molC-H键和1molC-C键,总共含有7mol共价键,15 g C2H6的物质的量=![]() =0.5mol,含有共价键的数目为3.5NA,故D错误;
=0.5mol,含有共价键的数目为3.5NA,故D错误;
答案选C。

【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |
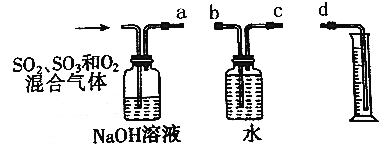
【题目】足量锌与一定量浓H2SO4充分在加热下反应生成会SO2和H2的混合气体。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中含有SO2和H2。取一定量的Zn置于b中,向a中加入100mL 18mol·L-1的浓硫酸,经过一段时间,恰好完全反应。
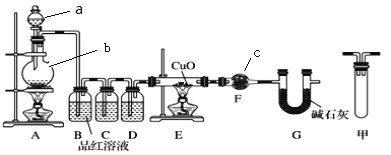
①填写仪器名称:c___________。
②实验开始前应先检验装置的气密性,请回答如何检验装置A的气密性___________。
③用化学方程式表示产生SO2的原因______________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥实验结束后测得装置F增重18.0g,计算实验开始时加入的Zn的质量为________g。你认为实际消耗Zn的质量应比计算值____________。(填“大”、“小”或“相同”)
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
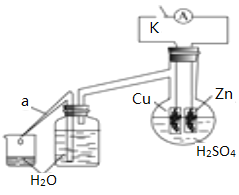
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。