题目内容
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
| A. | 在(t1+10)min时,其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向右移动 | |
| C. | T℃时,在相同容器中,若由0.3 mol•L-1 A、0.1 mol•L-1 B和0.4 mol•L-1C反应,达到平衡后,C的浓度仍为0.4 mol•L-1 | |
| D. | 该反应为吸热反应,温度升高,平衡正向移动,A的转化率升高 |
分析 该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应,据平衡的建立以及平衡的移动知识来回答.
解答 解:反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.该反应的正反应是气体体积减小的反应,t2时,保持其它条件和物质状态不变,增加压强,化学平衡向正反应方向移动,故A错误;
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,体积增大,相当于减小了压强,所以平衡逆向移动,故B错误;
C.T℃时,在相同容器中,若由0.3 mol•L-1 A、0.1 mol•L-1 B和0.4 mol•L-1C反应,将C转化为反应物,则A的是0.5mol/L,B的是0.7mol/L,所以和开始的投料一样,建立的平衡是等同的,所以达到平衡后,C的浓度仍为0.4 mol/L,故C正确;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选:C.
点评 本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡 |
| A. | s轨道呈球形,p轨道呈哑铃形 | B. | Cu元素在元素周期表的d区 | ||
| C. | 12g二氧化硅中有0.8NA个Si-O键 | D. | H2O中O原子的杂化方式是sp3 |
 据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:
据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质.请回答下列问题.
①下列说法不正确的是C.
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4$\frac{\underline{\;>1000K\;}}{\;}$MnFe2O4-X+$\frac{X}{2}$
则第二步反应的化学方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑(条件不写).
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是D.
A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据.已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3.
| 物质 | H2 | CO | CH4 |
| 热值/kJ•g-1 | 143 | 10 | 56 |
②家庭使用管道煤气和天然气,天然气 更经济合算.
③表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol.

 2,4-二甲基已烷
2,4-二甲基已烷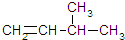 3-甲基-1-丁烯
3-甲基-1-丁烯
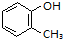
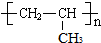
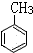 +3HO-NO2
+3HO-NO2
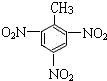 +3H2O
+3H2O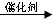 CH2=CHCl.
CH2=CHCl. .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是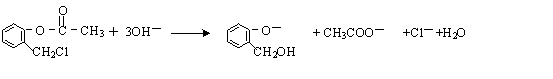 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物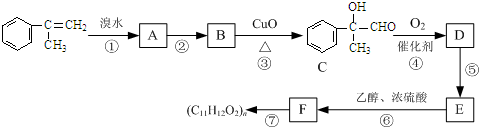
 、
、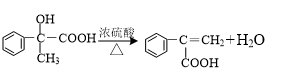 、
、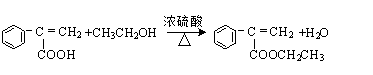 、
、 .
.