题目内容
下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
B
解析试题分析:离子的核外电子层数越多,离子半径越大。在核外电子排布相同的条件下,原子序数越小,离子半径越大,因此粒子半径是S2->Cl->K+>Al3+,①不正确;非金属性越强,氢化物的稳定性越强。同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则非金属性强弱顺序是F>Cl>S>P>Si,所以氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,②正确;非金属性越强,相应阴离子的还原性越弱。同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则非金属性强弱顺序是Cl>Br>I>S,所以离子的还原性:S2->I->Br->Cl-,③不正确;同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则氧化性:Cl2>S>Se>Te,④正确;根据(OH)mROn可知n值越大,含氧酸的酸性越强,所以酸性强弱顺序是H2SO4>H3PO4>H2CO3>HClO,⑤正确;同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则非金属性:O>N>P>Si,⑥正确;同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强,则金属性:Be<Mg<Ca<K,⑦正确,答案选B。
考点:考查元素周期律的应用

 名校课堂系列答案
名校课堂系列答案短周期元素的离子M2+和N2―具有相同的电子层结构,则下列说法正确的是
| A.M2+的离子半径比N2―小 | B.M的原子序数比N小 |
| C.M和N原子的电子层数相等 | D.M和N原子最外层电子数相等 |
某一个元素质量数是51,中子数是28,其基态原子未成对电子数为
| A.4 | B.1 | C.2 | D.3 |
某同学在学习核外电子排布的知识时,把15P原子的电子排布式写成了1s22s22P63s23Px23Py1,他违背了
| A.能量守恒原理 | B.泡利不相容原理 | C.能量最低原则 | D.洪特规则 |
下列说法中正确的是
| A.所有主族元素的正化合价数,等于它的族序数 |
| B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C.第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D.前三周期元素中共有非金属元素12种 |
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
| A.W2-、X+ | B.X+、 Y3+ | C.Y3+、 Z2- | D.X+、 Z2- |
右图为元素周期表中短周期的一部分,下列说法正确的是 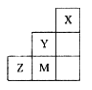
| A.非金属性:Y>Z>M |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是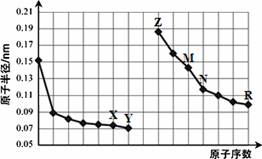
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X > Z > M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质不能从M与R元素构成的盐溶液中置换出单质M |
下列排列顺序正确的是( )
| A.还原性:H2O>HF>H2S |
| B.离子半径:Na+>Mg2+>Cl- |
| C.酸性:H3PO4>H2SO4>HClO4 |
| D.结合质子能力:OH->HCO3->CH3COO- |