题目内容
【题目】常温下,稀盐酸和氨水按不同体积比混合得到四种溶液,各取20mL溶液,用0.1molL﹣1NaOH溶液滴定,溶液的pH随NaOH溶液的体积变化如图所示,下列说法正确的是( )
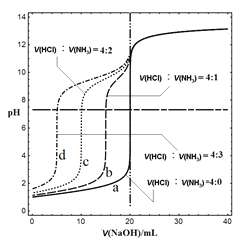
A. 滴至pH=7时,四种溶液中均存在c(Na+)=c(Cl﹣)
B. 原盐酸的浓度是0.1molL﹣1
C. V(NaOH)=10mL,溶液中Na+浓度a>b
D. 当V(NaOH)>20mL时,四种溶液的pH相同,溶液中的NH4+浓度近似相等
【答案】B
【解析】
A.根据电荷守恒,滴至pH=7时,c(H+)=c(OH-),则a溶液中c(Na+)=c(Cl﹣);b、c、d三种溶液中c(Na+)+c(NH4+)=c(Cl﹣),故A错误;
B.a溶液中稀盐酸和氨水按4:0的比例混合,溶液中只含盐酸,当滴入0.1molL﹣1NaOH溶液20mL时溶液呈中性,则盐酸的浓度为0.1molL﹣1,故B正确;
C. V(NaOH)=10mL,由于向a和b中加入的氢氧化钠的量相同,则溶液中Na+浓度a=b,故C错误;
D.当V(NaOH)>20mL时,根据电荷守恒,溶液中均存在 c(Na+)+ c(NH4+)+ c(H+)=c(OH-)+c(Cl﹣)。四种溶液中加入的氢氧化钠均相同,则溶液中的c(Na+)均相同,因为四种溶液的pH相同,则四种溶液中的c(H+)和c(OH-)均相同,又因为四种溶液中稀盐酸和氨水混合比例不同,则溶液中c(Cl-)大的,c(NH4+)小,则溶液中NH4+浓度不相等,故D错误。答案选B。

练习册系列答案
相关题目