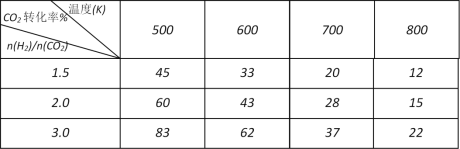
题目内容
【题目】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A与B同周期,且A元素原子核外s能级有1个未成对电子;C元素的原子序数比B多1,且C元素的原子核外p电子比s电子少1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子序数为27。请回答下列问题:
(1)第一电离能介于A和C之间的同周期元素有________________(填元素符号)。
(2)C元素的最高价氧化物所对应的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为__________________,写出任意一种与该阴离子互为等电子体的微粒的化学式_______________。
(3)与B元素同主族的元素硅,其四卤化物的沸点和铅的二卤化物熔点如图所示:

①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中化学键的离子性逐渐_____________(填“增强”、“不变”或“减弱”)。
(4)①元素D的+6价橙红色氧化物常用于检验酒驾,其在酸性条件下遇到乙醇会反应生成绿色的D3+离子,同时乙醇转化为一种无毒气体。请写出该反应的离子反应方程式____________________。
②元素D可以形成如图所示的配合物,该配合物中所含化学键的类型不包括________(填字母)。

a 极性共价键 b 非极性共价键 c 配位键 d 离子键 e 金属键 f σ键 g Π键
(5)已知E3+可形成配位数为6的配合物。现有橙黄色和紫红色两种E的配合物,其组成均可表示为ECl3·nNH3。为测定这两种配合物晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2:3 。则紫红色晶体的化学式为______________(用配合物的形式写出化学式,且E用元素符号表示,n用具体数字表示)。
【答案】Be、B、C、O 平面三角形 CO32- 或SO3(答案合理即可) 都为组成和结构相似的分子,随着相对分子质量增大,范德华力增强,沸点升高 减弱 C2H5OH+4CrO3+12H+ =4Cr3++9H2O+2CO2↑ e [Co(NH3)5Cl]Cl2
【解析】
A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。C元素的原子核外p电子比s电子少1,核外电子排布式为1s22s22p3,故C为N元素。C元素的原子序数比B多1,则B是C元素;A与B同周期,且A元素原子核外s能级有1个未成对电子,则A为Li;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾,只能属于过渡元素,价电子排布式为3d54s1,故D为Cr元素;E元素的原子序数为27,则E为Co元素。据此解答。
由分析可知,A为Li、B为C、C为N、D为Cr、E为Co。
(1)同周期主族元素随原子序数增大第一电离能呈增大趋势,但IIA族、VA族的第一电离能高于同周期相邻主族元素,故第一电离能:N>O>C>Be>B>Li,所以第一电离能介于A和C之间的同周期元素有Be、B、C、O;
(2)C元素的最高价氧化物的水化物在水溶液中能完全电离出的阴离子为NO3-,NO3-中N原子孤电子对数=![]() =0,价层电子对数=0+3=3,VSEPR模型即为离子空间构型,NO3-的空间构型为:平面三角形;与该阴离子互为等电子体的微粒,可以用S原子替换N原子与1个单位负电荷,可以用C原子、1个单位负电荷替换N原子,两种等电子体微粒为SO3、CO32-等;
=0,价层电子对数=0+3=3,VSEPR模型即为离子空间构型,NO3-的空间构型为:平面三角形;与该阴离子互为等电子体的微粒,可以用S原子替换N原子与1个单位负电荷,可以用C原子、1个单位负电荷替换N原子,两种等电子体微粒为SO3、CO32-等;
(3)①Si元素的SiX4都是分子晶体,这些物质结构相似,SiX4按F、Cl、Br、I次序,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化需要的能量就越高,物质的熔沸点就越高;
②PbX2中化学键的离子性越强,微粒之间的作用力越强,物质的熔沸点就越高。根据物质的沸点呈减小趋势,说明依F、Cl、Br、I次序,PbX2中化学键的离子性逐渐减弱;
(4)①Cr元素的+6价的氧化物CrO3具有强的氧化性,在酸性条件下可以将乙醇氧化为CO2,CrO3被还原为Cr3+,根据电子守恒、电荷守恒、原子守恒,该反应的离子方程式为:C2H5OH+4CrO3+12H+=4Cr3++9H2O+2CO2↑;
②碳原子之间形成非极性键,C与H原子、O原子之间形成极性键,水分子中O、H原子之间也形成极性键,O原子与Cr之间形成配位键,内界配离子与外界氯离子之间形成离子键,单键为σ键,双键含σ键、π键,没有金属键,故合理选项是e;
(5)Co3+的配位数均为6,组成均可表示为ECl3·nNH3,3+n=6;往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有Cl-在配合物的外界,两份沉淀,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2:3,可知紫红色晶体中含2个氯离子在外界,内界有1个Cl-,紫红色晶体的化学式为[Co(NH3)5Cl]Cl2,橙黄色晶体中含3个氯离子在外界,则内界不含Cl-,故橙黄色晶体的化学式为[Co(NH3)6]Cl3。

【题目】通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。对下列实验事实解释正确的是
现象 | 解释 | |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
C | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去 | BaCl2溶液具有酸性 |
D | 向盐酸中加入浓硫酸时产生白雾 | 浓硫酸具有脱水性 |
A.AB.BC.CD.D