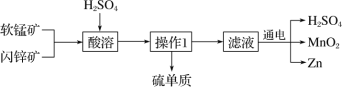
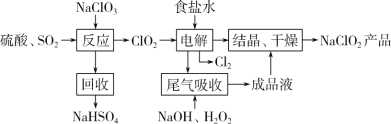
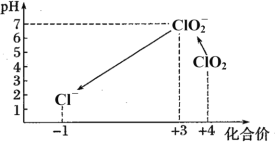
题目内容
【题目】X是某药物的中间体,其结构简式如图所示。下列有关X的说法正确的是
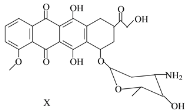
A. 每个X分子中含有5个手性碳原子
B. 一定条件下,X能与乙醇发生酯化反应
C. 一定条件下,X能发生消去反应
D. X既能与盐酸反应,又能与NaOH溶液反应
【答案】CD
【解析】
有机物含有羰基、酚羟基、醇羟基、氨基,可结合酚、醇、胺的性质解答该题。
A.连接四个不同的原子或原子团的碳原子为手性碳原子,由结构简式可以知道应含有6个手性碳原子,故A错误;
B.X不含有羧基,不与乙醇发生酯化反应,故B错误;
C.含有羟基,且邻位碳原子连接H,可发生消去反应,所以C选项是正确的;
D.含有氨基,可与盐酸反应,含有酚羟基,可与氢氧化钠溶液反应,所以D选项是正确的。
所以CD选项是正确的。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
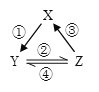
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ① 常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ② 通入CO2 | |
C. | Fe | FeCl2 | FeCl3 | ③ 加入Cu | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④ 加NaOH溶液 |
A. AB. BC. CD. D