题目内容
【题目】亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
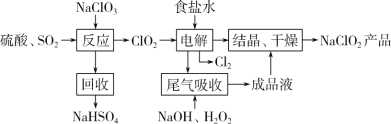
已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO23H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2 分解成NaClO3 和NaCl。
(1)写出“反应”步骤中的还原产物:__________。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:
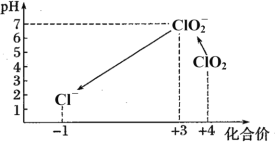
在步骤(3)过程中,溶液又呈蓝色,其原因是_________。
【答案】ClO2Na2CO3溶液、NaOH溶液2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2用 38℃—60℃的温水洗涤2ClO2+2KI=2KClO2+I20.135ClO2—在酸性环境中又将I—氧化为I2,淀粉遇I2变蓝色
【解析】
(1) “反应”步骤中硫酸、二氧化硫、NaClO3反应生成NaHSO4、ClO2,根据化合价变化分析还原产物;(2)粗盐精制时,用生成碳酸钙、氢氧化镁沉淀的方法除去Ca2+和 Mg2+;(3)根据流程图可知,“尾气吸收”是用氢氧化钠、H2O2吸收“电解”过程中排出的少量ClO2,生成NaClO2,根据得失电子守恒可知,产物中还有氧气;(4)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,用38-60℃的温水洗涤;(5)根据已知:ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中;向含有ClO2的水样中,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝,说明生成碘单质和KClO2。(6)根据2ClO2+2KI=2KClO2+I2、2Na2S2O3+I2=Na2S4O6+2NaI,找出关系式,2ClO2--I2--2S2O32-,根据关系式计算水样中ClO2的质量分数;(7)向(6)所得溶液中加硫酸调节水样pH至1~3,ClO2-表现氧化性,被还原为Cl-;
(1) “反应”步骤中硫酸、二氧化硫、NaClO3反应生成NaHSO4、ClO2,NaClO3中氯元素化合价降低生成ClO2,所以还原产物是ClO2;(2)粗盐精制时,用生成碳酸钙、氢氧化镁沉淀的方法除去Ca2+和 Mg2+,要加入的试剂分别为Na2CO3溶液、NaOH溶液;(3)根据流程图可知,“尾气吸收”是用氢氧化钠、H2O2吸收“电解”过程中排出的少量ClO2,生成NaClO2和氧气,反应离子方程式是2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2;(4)根据以上分析,“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用 38℃—60℃的温水洗涤;④38℃~60℃干燥,得到产品。(5)向含有ClO2的水样中,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝,说明生成碘单质和KClO2,反应方程式是2ClO2+2KI=2KClO2+I2。
(6)设水样中ClO2的质量为x mg
2ClO2 -- I2 -- 2S2O32-,
135000mg 2mol
Xmg 5.00×10—5mol·L-1![]() 0.02L
0.02L
![]()
X=0.0675mg
水样中ClO2的质量分数![]() 0.135 mg·L-1 ;
0.135 mg·L-1 ;
(7)向(6)所得溶液中加硫酸调节水样pH至1~3,ClO2-在酸性环境中又将I-氧化为I2,淀粉遇I2变蓝色。

【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
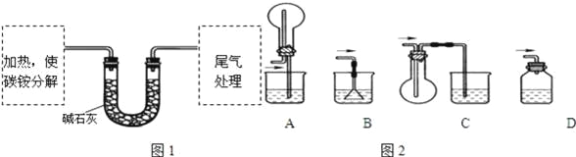
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.