题目内容
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
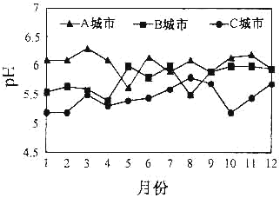
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
【答案】a b b 蛋白质 苯甲酸钠(苯甲酸钠和食盐) 淀粉 (C6H10O5)n+nH2O![]() nC6H12O6 C SO2 燃煤脱硫 3NO2+H2O=2HNO3+NO 2NO+2CO
nC6H12O6 C SO2 燃煤脱硫 3NO2+H2O=2HNO3+NO 2NO+2CO![]() N2+2CO2
N2+2CO2
【解析】
(1)①聚氨酯根据名称属于聚合物,属于有机高分子材料;答案选a;
②铝合金属于金属材料,合金具有硬度大、耐热性好、抗腐蚀等优良性质,而铝合金还具有密度小的优点;答案选b;
③玻璃为传统的三大硅酸盐材料之一,主要原料为纯碱、石灰石和石英;答案为b;
(2)大豆为富含蛋白质的食物,蛋白质水解最终得到氨基酸,答案为蛋白质;
②配料中有水、大豆、小麦、食盐、焦糖、苯甲酸钠。水、大豆、小麦、焦糖都起不到防腐的作用。食盐主要成分NaCl,如果浓度较高,会导致微生物体内脱水死亡,所以可以杀菌起到防腐效果。苯甲酸钠,是一种广谱抗微生物的物质,对酵母菌,霉菌等具有良好的效果;答案为苯甲酸钠(苯甲酸钠和食盐);
③小麦主要成分为淀粉,淀粉最终水解产物为葡萄糖,化学方程式为(C6H10O5)n+nH2O![]() nC6H12O6;
nC6H12O6;
(3)①pH越低,受到酸雨的危害越严重。从图中可知,C城市全年雨水pH的月均值在三个城市中最低,受到的酸雨的危害最大;
②硫酸型酸雨主要是由于SO2排放过多,SO2溶于水生成H2SO3,H2SO3再被O2氧化得到H2SO4;减少燃煤过程中SO2的排放的方法有燃煤脱硫,也可以在燃烧过程中加入石灰石;答案为SO2 燃煤脱硫;
③NO2溶于水生成HNO3和NO,形成硝酸型酸雨,化学方程式为3NO2+H2O=2HNO3+NO;NO和CO转化为无害的气体,为N2和CO2,化学方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。

【题目】2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。
已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。
(1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
A | 青蒿素在水中的溶解度很大 | B | 青蒿素含有亲脂的官能团 |
C | 在低温下提取青蒿素,效果会更好 | D | 乙二醇提取青蒿素的能力强于乙醚 |
(2)用下列实验装置测定青蒿素实验式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
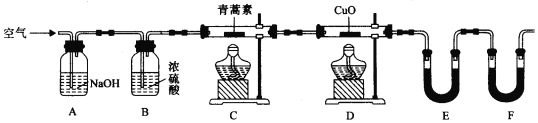
①装置D的作用是______,装置E中吸收的物质是______,装置F中盛放的物质是______。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是_____。
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
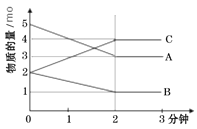
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)由图求得平衡时A的转化率为_______。
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
请完成此实验设计,其中:V1=_______,V6=_______。