题目内容
【题目】(1)F2通入稀NaOH溶液中可生成OF2,OF2立体构型为___,其中氧原子的杂化方式为___。
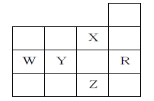
(2)X、Y、Z、R为前四周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。XY2-的立体构型是___;X与Z形成化合物中含有的化学键是___、R2+的水合离子中,提供孤电子对的原子是___。
(3)ClO3-的立体构型为___(用文字描述,下同);CO32-的立体构型是__。
(4)在BF3分子中:F—B—F的键角是___,B原子的杂化轨道类型为__,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___。
(5)用价层电子对互斥理论推断,SnBr2分子中Sn—Br键的键角___(填“>”“<”或“=”)120°。其原因是___。
【答案】V形 sp3 V形 离子键 氧原子 三角锥形 平面三角形 120° sp2 正四面体形 < SnBr2分子中Sn原子有一对孤电子对,孤电子对与σ键电子对相互排斥,所以Sn—Br键的键角小于120°
【解析】
(1)根据价层电子对互斥理论分析,先计算价层电子对数,再判断中心原子的杂化类型及分子构型;
(2)X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,应是NO2,则X为N元素、Y为O元素;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等,则M层电子数为2,故Z为Mg;R2+离子的3d轨道中有9个电子,R原子核外电子数=2+8+8+9+2=29,则R为Cu元素,据此解答;
(3)根据价层电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(4) 根据价层电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(5)首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型。
(1)OF2分子中O原子的价层电子对数=2+![]() (62×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
(62×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
(2)NO2离子中心N原子孤电子对=![]() (5+12×2)=1,价层电子对数=2+1=3,故NO2离子的立体构型是V形,氮原子和镁原子形成Mg3N2,主要含有离子键,Cu2+的水合离子中,提供孤电子对的原子是H2O中O原子;
(5+12×2)=1,价层电子对数=2+1=3,故NO2离子的立体构型是V形,氮原子和镁原子形成Mg3N2,主要含有离子键,Cu2+的水合离子中,提供孤电子对的原子是H2O中O原子;
(3) ClO3-的孤电子对数=![]() (7+12×3)=1,价层电子对数为3+1=4,立体构型为三角锥形,CO32-的孤电子对数=
(7+12×3)=1,价层电子对数为3+1=4,立体构型为三角锥形,CO32-的孤电子对数=![]() (4+22×3)=0,立体构型为平面三角形;
(4+22×3)=0,立体构型为平面三角形;
(4) BF3分子的中心原子B原子上含有3个σ键,中心原子上的孤电子对数=![]() (33×1)=0,所以BF3分子属于sp2杂化,VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3和过量NaF作用可生成NaBF4,BF4中B原子的价层电子对=4+
(33×1)=0,所以BF3分子属于sp2杂化,VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3和过量NaF作用可生成NaBF4,BF4中B原子的价层电子对=4+![]() (3+14×1)=4,该离子中不含孤电子对,属于sp3杂化,为正四面体结构;
(3+14×1)=4,该离子中不含孤电子对,属于sp3杂化,为正四面体结构;
(5)SnBr2分子中,Sn原子的价层电子对数目是![]() (4+2) =3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,SnBr2分子中Sn原子的有一对孤电子对,孤电子对与σ键电子对相互排斥,所以Sn—Br键的键角小于120°。
(4+2) =3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,SnBr2分子中Sn原子的有一对孤电子对,孤电子对与σ键电子对相互排斥,所以Sn—Br键的键角小于120°。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾