题目内容
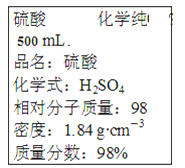
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
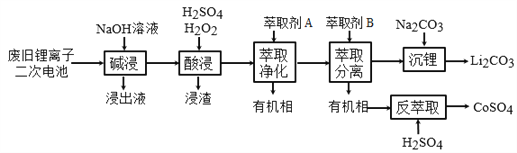
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
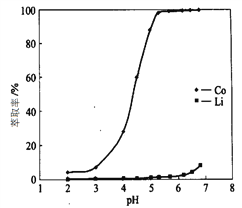
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
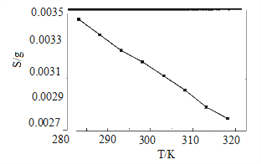
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
【答案】 除去铝 2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O 石墨、硫酸钙 Fe3+ 分离效率最高 Li2CO3溶解过程为放热反应 洗涤 88.0%
【解析】分析:本题是化学流程图问题,主要是判断清楚每步反应的投料和产出,各个步骤的流程,最后分析清楚杂质是如何除去的。
详解:(1)“碱浸”的目的是用氢氧化钠溶液将其中的Al溶解。
(2)LiCoO2中Co为+3价,最后生成的CoSO4中Co为+2价,所以酸浸这一步中,加入H2O2的目的是为了将+3价Co还原为+2价Co,所以反应的而梨子反应方程式为:2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O。浸渣中主要是不与酸反应的石墨以及生成的硫酸钙沉淀。
(3)整个提取的过程中需要除去的杂质是Ca、Fe、Al、Ni;在前面的步骤中已经除去了Al和Ca,所以萃取净化应该要除去Ni2+和Fe3+。
(4)由图示在pH为5左右的时候,Co和Li的萃取率差异最大,此时分离的效果最好。
(5)①图中显示随着温度升高,碳酸锂的溶解度逐渐减小,所以褪色该物质溶于水的过程是放热的。
②提取的过程为热过滤,洗涤,干燥,所以答案为:洗涤。
③c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,则碳酸钠的浓度也是1.0 mol·L1,加入的瞬间溶液体积转化为原来的2倍,浓度都是原来的一半,即c(Li+)= c(CO32-)=0.5 mol·L1,沉淀出碳酸锂,所以碳酸根过量1倍,剩余c(CO32-)=0.25 mol·L1,带入KSP的计算式得到c(Li+)= ![]() mol/L。因为两溶液混合的瞬间c(Li+)=0.5mol/L,所以沉锂率为(0.5-0.06)÷0.5=88%。
mol/L。因为两溶液混合的瞬间c(Li+)=0.5mol/L,所以沉锂率为(0.5-0.06)÷0.5=88%。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
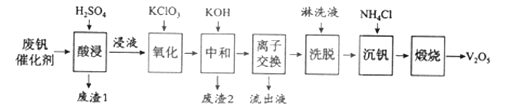
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。