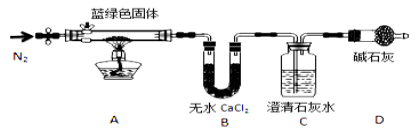
题目内容
【题目】某强酸性的透明溶液中可能含有下列微粒中的几种。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子: H2SO3
取该溶液进行以下连续实验。
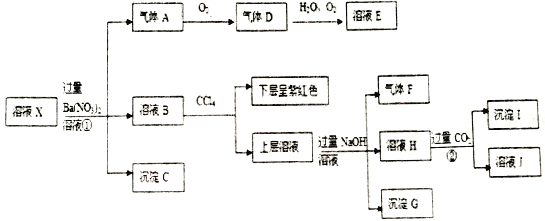
根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是__________________;
(2)沉淀I的化学式为_____________;
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是_____________。
【答案】 SiO32-、CO32-、ClO-、SO32- Al(OH)3 I-、NH4+、Fe2+、H2SO3
【解析】根据强酸性溶液,排除与氢离子不能大量共存的离子以及在酸性溶液中会发生氧化还原反应的离子。结合图中的有关转化和物质的性质分析解答。
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是能与氢离子反应的离子,即弱酸的酸根离子:SiO32-、CO32-、ClO-、SO32-;(2)加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有亚硫酸分子,则一定不存在MnO4-、Fe3+;生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,为Fe2+离子或碘离子,溶液B中加入四氯化碳,下层呈紫红色,说明有碘生成,即一定存在碘离子,所以不存在银离子。上层溶液中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有铵根离子,溶液H中溶于CO2气体,生成沉淀I,则I为氢氧化铝,H为NaOH和NaAlO2,说明溶液中含有Al3+离子;沉淀G是氢氧化铁,即溶液中一定存在亚铁离子。(3)根据以上分析可知X溶液中,除H+、Al3+外还肯定含有的微粒是I-、NH4+、Fe2+、H2SO3。

 名校课堂系列答案
名校课堂系列答案