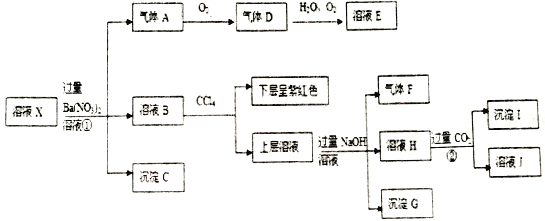
题目内容
【题目】能正确表示下列反应的离子方程式是( )
A.金属铝溶于稀硫酸中:Al+2H+===Al3++H2↑
B.碳酸锌溶于稀硝酸中:CO+2H+===H2O+CO2↑
C.醋酸钠水溶液中通入足量CO2: 2CH3COO-+CO2+H2O===2CH3COOH+CO
D.H2SO4与Ba(OH)2溶液反应: Ba2++2OH-+2H++SO===BaSO4↓+2H2O
【答案】D
【解析】A选项电荷、电子得失均不守恒,错误;碳酸锌不溶于水,应写成化学式,B错误;CO2与醋酸钠溶液不反应,C错误;只有D项正确。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目