题目内容
Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol,被还原的HNO3是___________g。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol,被还原的HNO3是___________g。
(1) 3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O;
(2) 62..72;8.2; (3)1.5;441
(2) 62..72;8.2; (3)1.5;441
(1)根据反应物和生成物可知,Fe3P失去14个电子。硝酸当还原产物是NO,硝酸得到3个电子,所以氧化剂和还原剂的物质的量之比是14︰3,因此反应式为3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O。
(2)根据方程式可知,当生成1.8 mol Fe3+时,生成NO是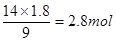 ,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是
,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是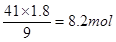 。
。
(3)根据方程式可知,当转移42mol电子时,生成磷酸时3mol,所以当有21 mol电子发生转移时,生成H3PO4是1.5mol。被还原的硝酸是7mol,质量是7mol×63g/mol=441g。
(2)根据方程式可知,当生成1.8 mol Fe3+时,生成NO是
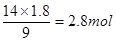 ,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是
,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是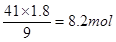 。
。(3)根据方程式可知,当转移42mol电子时,生成磷酸时3mol,所以当有21 mol电子发生转移时,生成H3PO4是1.5mol。被还原的硝酸是7mol,质量是7mol×63g/mol=441g。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O