题目内容
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。
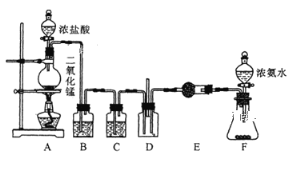
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,写出该反应的化学方程式__________
(2)C、E都是干燥装置,其中E中干燥管内所装的试剂是__________
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。
步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中含有__________离子
步骤②:向另一支试管中加入硝酸酸化的硝酸银溶液,若产生白色沉淀,说明溶液中含有__________离子
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。__________
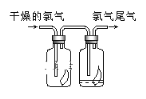
(5)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是___________________________。
【答案】4HCl+MnO2![]() MnCl2+Cl2↑+2H2O 碱石灰 NH4+ Cl- 将D装置的竖直导管口套一个气囊收集尾气,以防尾气污染环境 干燥的有色布条不褪色,潮湿的有色布条褪色
MnCl2+Cl2↑+2H2O 碱石灰 NH4+ Cl- 将D装置的竖直导管口套一个气囊收集尾气,以防尾气污染环境 干燥的有色布条不褪色,潮湿的有色布条褪色
【解析】
(1)用二氧化锰和浓盐酸反应制取氯气,该反应的化学方程式为4HCl+MnO2![]() MnCl2+Cl2↑+2H2O ,因此,本题正确答案是: 4HCl+MnO2
MnCl2+Cl2↑+2H2O ,因此,本题正确答案是: 4HCl+MnO2![]() MnCl2+Cl2↑+2H2O ;
MnCl2+Cl2↑+2H2O ;
(2)洗气瓶B装饱和食盐水目的除去Cl2中的HCl,E干燥氨气,则E中干燥管内所装的试剂是碱石灰,因此答案是碱石灰;
(3)D中发生8NH3+3Cl2═6NH4Cl +N2,白烟为氯化铵,向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,气体为氨气,则该固体中一定含有的阳离子是NH4+;向其中一支试管中加入硝酸酸化的硝酸银,有白色沉淀生成,则含Cl-,因此,答案是: NH4+、Cl-;
(4)氯气、氨气均不能直接排放在环境中,D中导管无尾气吸收,不符合绿色化学的思想,应在D的导管上装一个气球,因此答案是:无尾气吸收,在D的导管上装一个气球。
(5)氯气溶于水生成次氯酸,次氯酸有漂白作用,干燥的氯气不会使有色布条褪色,能使潮湿的有色布条褪色;答案:干燥的有色布条不褪色,潮湿的有色布条褪色。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。