题目内容
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
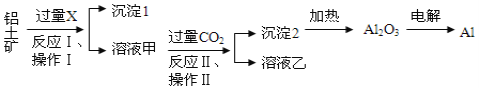
试回答下列问题:
(1)试剂X为__________;
(2)操作Ⅰ、操作Ⅱ均为_____________(填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______________________________,请举一例该反应的用途________________________;
(4)反应Ⅱ的离子方程式为____________________________________________________;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
【答案】 NaOH溶液 过滤 烧杯、漏斗、玻璃棒 2Al+Fe2O3=2Fe+Al2O3 焊接铁轨 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 5.4
【解析】氧化铝属于两性氧化物,能溶于强酸和强碱,所以氧化铝和氢氧化钠反应,离子方程式为:Al2O3+OH-=2AlO2-+H2O,生成可溶性的偏铝酸钠和水,为溶液甲,同时得到沉淀1,二氧化碳和偏铝酸钠反应生成氢氧化铝和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3 ↓+HCO3-,沉淀2为Al(OH)3 ,溶液乙为NaHCO3溶液。
(1)Al2O3常用NaOH溶解,试剂X为NaOH溶液,答案:NaOH溶液
(2)操作Ⅰ、操作Ⅱ均为过滤,需要的玻璃仪器有:烧杯、漏斗、玻璃棒,答案:烧杯、漏斗、玻璃棒;
(3)金属铝与氧化铁混合在高温下, 2Al+Fe2O3![]() 2Fe+Al2O3,铝热反应的应用有焊接铁轨,冶炼难熔金属等,答案: 2Al+Fe2O3
2Fe+Al2O3,铝热反应的应用有焊接铁轨,冶炼难熔金属等,答案: 2Al+Fe2O3![]() 2Fe+Al2O3, 焊接铁轨(其它合理答案均给分)
2Fe+Al2O3, 焊接铁轨(其它合理答案均给分)
(4)反应Ⅱ的离子方程式为AlO2-+CO2+2H2O=Al(OH)3 ↓+HCO3-,答案: AlO2—+CO2+2H2O![]() Al(OH)3↓+HCO3—
Al(OH)3↓+HCO3—
(5)电解氧化铝的方程式为:2Al2O3![]() 4Al+3O2↑,
4Al+3O2↑,
设得到铝的质量为x,
2Al2O3 ![]() 4Al+3O2↑ 转移电子
4Al+3O2↑ 转移电子
108g 12mol
x 0.6mol
108g:12mol=x:0.6mol
x=108g×0.6mol/12mol
=5.4 g
故答案为:5.4g.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案