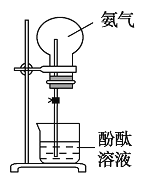
题目内容
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O ═ 2Fe2+ + 4SO42 + 4H+实现该反应的物质间转化如图所示。下列分析正确的是
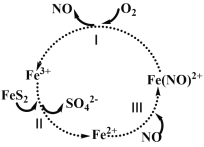
A.反应Ⅰ的离子方程式为4Fe(NO)2+ + O2+ 4H+ ═ 4Fe3+ +4NO + 2H2O,Fe(NO)2+作氧化剂
B.反应Ⅱ中Fe3+作氧化剂,FeS2被还原
C.在酸性条件下,黄铁矿催化氧化中NO作催化剂
D.反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,该反应是氧化还原反应
【答案】C
【解析】
A. 反应Ⅰ的离子方程式为4Fe(NO)2++ O2+ 4H+ ═ 4Fe3+ +4NO+ 2H2O,Fe(NO)2+作还原剂,因为铁元素的化合价由+2价到+3价,化合价升高,故A错误;
B. 反应Ⅱ中Fe3+作氧化剂,FeS2被氧化,因为硫元素的化合价升高,故B错误;
C. 在酸性条件下,黄铁矿催化氧化中NO作催化剂,由图可以看出,故C正确;
D. 反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,所含元素的化合价没有发生变化,该反应是非氧化还原反应,故D错误;
故选:C。

【题目】(1)A、B、C为同一短周期金属元素。依据下表数据分析,A、B、C三种元素的离子半径由大到小的顺序是_____。(用离子符号表示)
电离能/kJmol-1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
(2)已知H2O2分子的空间结构如图所示,H2O2分子中氧原子采取____________杂化;H2O2分子是______(填“极性分子”或“非极性分子”)。
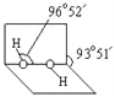
(3)R是第4周期元素中未成对电子数最多的原子。R3+在溶液中存在如下转化:
R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_____。
②[R(OH)4]-中存在的化学键是_____;1mol[R(OH)4]-离子中含有σ键的数目为_______mol。
A.离子键 B.极性键 C.非极性键D .配位键