题目内容
已知:在室温时H2O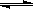 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH 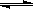 H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
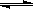 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH 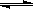 H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
(1)减小(2)CH3COO— + H2O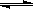 CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12
CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12
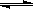 CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12
CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12 试题分析:(1)因醋酸钠固体电离产生CH3COO-,c(CH3COO-)增大,使的平衡CH3COOH?CH3COO-+H+逆向移动,C(H+)减小,C(CH3COOH)增大,所以C(H+)与C(CH3COOH)的比值减小,故答案为:减小;(2)醋酸钠水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,该反应是吸热反应,温度升高,溶液中氢氧根离子浓度增大,故答案为:CH3COO-+H2O?CH3COOH+OH-;增大;(3)由于醋酸钠溶液中,醋酸钠的浓度越大,水解程度越小,但是溶液中的氢氧根离子的物质的量浓度反而越大,溶液的PH越大,所以m小于n,a大于b,故答案为:小于;大于;(4)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);(5)由于溶液的PH小于7,溶液中氢离子物质的量浓度大于氢氧根离子的浓度,氢离子主要是醋酸电离的,所以醋酸根离子浓度大于钠离子浓度,故答案为:小于;(6)A、若反应后溶液呈中性,溶液中氢离子浓度=氢氧根离子浓度=1×10-7mol?L-1c(H+)+c(OH-)=2×10-7mol?L-1,故A说法正确;B、醋酸是弱电解质部分电离,醋酸的浓度大于氢氧化钠的浓度,若V1=V2,反应后溶液pH一定小于7,故B说法错误;C、若反应后溶液呈酸性,由于醋酸浓度大于氢氧化钠浓度,则V1≤V2,故C说法错误;D、若反应后溶液呈碱性,由于V1=V2溶液显示酸性,所以V1一定小于V2,故D说法正确;(7)溶液中氢氧根离子浓度是:[OH-]=2.2×10-5mol?L-1,根据[M2+][OH-]2=5×10-12(mol?L-1)3,由于5×10-12小于KSP[M(OH)2]=1.8×10-11,没有氢氧化镁沉淀生成,由于5×10-12大于KSP[Zn(OH)2]=1.2×10-17,有氢氧化锌淀生成,由于5×10-12大于KSP[Cd(OH)2]=2.5×10-14,有Cd(OH)2沉淀生成,故答案为:Cd2+、Zn2+;(8)稀释后溶液中的氢离子浓度是:c(H+)=0.5mol?L?1×0.01L/0.5L=0.01mol/L,由于盐酸溶液中,水电离的氢离子浓度等于溶液中的氢氧根离子的浓度,该溶液中由水电离出的c(H+)=1×10-12,故答案为:1×10-12.

练习册系列答案
相关题目


 、OH-
、OH- 、
、