题目内容
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
B
试题分析:A.发生反应:2Fe3++2I-=2Fe2++I2.不能共存。错误。B. pH值为1的溶液是酸性溶液,此时H+和Cu2+、Na+、Mg2+、NO3-不会发生任何反应。可以共存。正确。C. 在室温下纯水电离出来的c(H+)= 10-7mol/L.现在溶液中水电离出来的c(H+)=10-13mol/L<10-7 mol/L,说明水的电离受到了抑制,可能外加了酸或碱。在酸性溶液中H++HCO3-=H2O+CO2↑;在碱性溶液在OH-+HCO3-=H2O+CO32-。可见无论是酸性还是碱性都不能大量共存。错误。D.发生反应:3CO32-+2Al3+ +3H2O=2Al(OH)3↓+3CO2↑.不能大量共存。错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
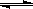 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH