题目内容
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:_____________ 。
(2)实验室进行蒸发浓缩用到的主要仪器有___________、烧杯、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是____________________。
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
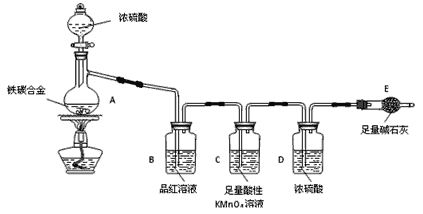
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是____________。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。

甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________________________。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是___________________________________________。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为___________ 。
【答案】 (NH4)2SO4+2NaCl![]() Na2SO4+2NH4Cl 蒸发皿 防止氯化铵晶体析出而损耗 AD 重结晶 A、B装置间缺一个干燥装置 使氯化铵充分反应完全转化为NH3 20.7%
Na2SO4+2NH4Cl 蒸发皿 防止氯化铵晶体析出而损耗 AD 重结晶 A、B装置间缺一个干燥装置 使氯化铵充分反应完全转化为NH3 20.7%
【解析】(1)由溶解度曲线可知,氯化铵的溶解度受温度影响较大,尤其是温度大于40℃时,硫酸钠溶解度随温度升高反而降低,故可利用复分解反应生成氯化铵,冷却热的饱和溶液结晶即可,制备NH4Cl的化学方程式为:(NH4)2SO4+2NaCl![]() Na2SO4+2NH4Cl。
Na2SO4+2NH4Cl。
(2)蒸发操作中的仪器有蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)等。
(3)趁热过滤,除去硫酸钠,得到氯化铵溶液,防止温度降低,氯化铵晶体析出而损失,所以应“趁热”过滤。
(4)静置、缓慢冷却、溶剂自然蒸发,避免了局部过浓导致的过饱和,利于得到较大的晶体,故选AD。
(5)氯化铵的溶解度受温度影响较大,40℃以上时硫酸钠溶解度受温度影响小,故NH4Cl产品中含有硫酸钠杂质,可采用反复多次结晶的方法进一步提纯产品,即重结晶法;甲同学:A、B装置间缺一个干燥装置,氨气在进入B之前没被干燥,所以含氮量偏高;乙同学:烧瓶中发生的是强碱与铵盐溶液的反应:NH4++OH-= NH3↑+H2O,要使铵根离子全部转化为氨气,碱要足量并充分加热;实验后B装置增重3.4g即为氨气的质量,所以氮元素的质量为3.4g×![]() =2.8g,所以含氮量为2.8g÷13.5g×100%≈20.7%。
=2.8g,所以含氮量为2.8g÷13.5g×100%≈20.7%。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案