题目内容
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lgKa。下列有关叙述错误的是
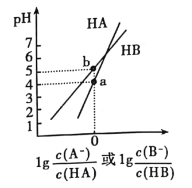
A. HA、HB两种酸中,HB的酸性弱于HA
B. b点时,c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—)
C. 同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D. 向HB溶液中加入NaOH溶液所得的混合溶液中![]()
【答案】C
【解析】
A、a点![]() ,pH=4,即
,pH=4,即![]() 时pH=4, Ka(HA)=10-4,b点
时pH=4, Ka(HA)=10-4,b点![]() ,pH=5,Ka(HB)=10-5,所以HA、HB两种酸中,HB的酸性弱于HA,故A正确;
,pH=5,Ka(HB)=10-5,所以HA、HB两种酸中,HB的酸性弱于HA,故A正确;
B、b点![]() ,
,![]() ,根据电荷守恒,c(Na+)+c(H+)=c(OH—) +c(B—),pH=5,溶液呈酸性c(H+)>c(OH—),所以c(Na+)<c(B—),b点溶液中c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—),故B正确;
,根据电荷守恒,c(Na+)+c(H+)=c(OH—) +c(B—),pH=5,溶液呈酸性c(H+)>c(OH—),所以c(Na+)<c(B—),b点溶液中c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—),故B正确;
C、根据A选项,HB的酸性弱于HA,B—水解程度大于A—,所以根据电荷守恒可知同浓度同体积的NaA和NaB溶液中,阴离子总数NaA大于NaB,故C错误;
D、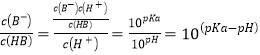 ,故D正确。选C。
,故D正确。选C。

练习册系列答案
相关题目