题目内容
【题目】
硼元素对植物生长及人体健康有着十分重要的作用,硼的化合物被广泛应用于新材料制备、生活生产等诸多领域。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
A.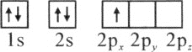
B.
C.
D.
(2)晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的________。
(3)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。
①H3BO3晶体中单元结构如图Ⅰ所示。各单元中的氧原子通过________氢键(用“A—B…C”表示,A、B、C表示原子)连结成层状结构,其片层结构如图Ⅱ所示,层与层之间以________(填作用力名称)相结合构成整个硼酸晶体。

②硼氢化钠中![]() 的键角大小是________,立体构型为________。
的键角大小是________,立体构型为________。
③根据上述结构判断下列说法正确的是________
a.H3BO3分子的稳定性与氢键有关
b.硼酸晶体有滑腻感,可作润滑剂
c.H3BO3分子中硼原子最外层为8e-稳定结构
d.含1mol H3BO3的晶体中有3 mol氢键
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是________;已知晶胞边长为a pm,则磷化硼晶体的密度是________g·cm-3(列出含a、NA的计算式即可)。

【答案】A D 自范性 sp3杂化 N C2H6 O﹣H…O 范德华力 109°28' 正四面体 bd 正方形 ![]()
【解析】
根据原子轨道能量的高低判断电子排布式;根据等电子体结构原理判断分子的结构;根据晶胞中原子的数目及晶胞的边长计算晶胞的密度。
(1)原子轨道能量的高低顺序为:ns<np<nd<nf,1s<2s<3s<4s,根据能量最低原理,能量最低为A排布,最高的分别为D排布,故答案为:A;D;
(2)在适宜的条件下,晶体能够自发地呈现封闭的规则和凸面体外形的性质,晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象;晶体硼单质能自发呈现出正二十面体的多面体外形,故答案为:自范性;
(3)①根据B2H6分子的空间结构知,B原子的轨道向4个方向延伸,则的杂化方式为sp3杂化;
②氨硼烷(NH3BH3)中氨基存在孤电子对,所以提供孤电子对的成键原子是N;与氨硼烷互为等电子体的分子为:C2H6;故答案为:N;C2H6;
(4)①根据H3BO3晶体中单元结构知,各单元中的氧原子通过 O﹣H…O连结成层状结构;如图Ⅱ所示,层与层之间没有化学键,以范德华力相结合构成整个硼酸晶体;
②硼氢化钠中![]() 与甲烷为等电子体,所以键角和甲烷中键角相同,大小是109°28'; 立体构型为正四面体;
与甲烷为等电子体,所以键角和甲烷中键角相同,大小是109°28'; 立体构型为正四面体;
③a.氢键较弱,不是化学键,所以H3BO3分子的稳定性与氢键无关,a说法错误;
b.硼酸晶体类似于石墨的层状结构,有滑腻感,可作润滑剂,b说法正确;
c.H3BO3分子中硼原子最外层为6e-结构,c说法错误;
d.如图所示,一个分子中有3个氢原子,可以形成3个氢键,所以含1mol H3BO3的晶体中有3 mol氢键,d的说法错误;故答案为:O﹣H…O;范德华力;109°28';bd;
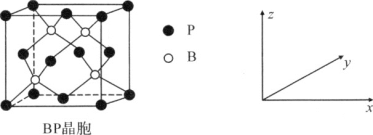
(5)由图所示,结合结构的对称性,B原子的投影构成的几何形状为正方形;晶胞中P原子的数目为:8×1/8+6×1/2=4,B原子数目为:4,则晶胞的质量为:![]() g,晶胞的体积为(a×10-10)3cm-3,所以晶胞的密度为:
g,晶胞的体积为(a×10-10)3cm-3,所以晶胞的密度为:![]() ,故答案为:正方形;
,故答案为:正方形;![]() 。
。

 阅读快车系列答案
阅读快车系列答案



