题目内容
【题目】某小组同学利用下图所示装置探究氨气的性质。

请回答:
(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是____________________。
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显______(填字母)。
a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是_________________________________。
(4)①、②中的现象说明氨气能与______(填化学式)发生化学反应。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O a 有白烟生成 H2O、HCl
CaCl2+2NH3↑+2H2O a 有白烟生成 H2O、HCl
【解析】
(1)实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气;
(2)氨气易溶于水,氨水显碱性;
(3)氨气与氯化氢反应;
(4)根据氨气的性质分析;
(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为: Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
因此,本题正确答案是: Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)氨气极易溶于水,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性, ①中湿润的红色石蕊试纸变蓝;因此,本题正确答案是:a。
(3)向②中滴入浓盐酸,浓盐酸挥发出的HCl遇NH3反应生成氯化铵固体,有白烟生成;
因此,本题正确答案是:有白烟生成。
(4)①、②中的现象说明氨气能与H2O、HCl反应,分别生成一水合氨、氯化铵,;因此,本题正确答案是: H2O、HCl。

【题目】工业水合肼法制备叠氮化钠的工艺流程如图所示:
一、合成水合肼
己知:![]() (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。![]() (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
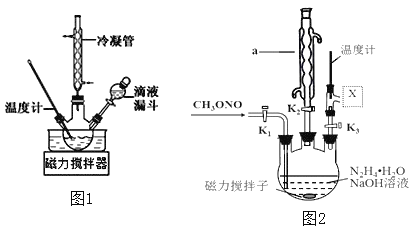
合成![]() 的装置如图1所示。
的装置如图1所示。![]() 碱性溶液与尿素
碱性溶液与尿素![]() 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出![]() 的结构式____________,
的结构式____________,![]() 的电子式____________
的电子式____________
(2)①写出制取![]() 的离子方程式___________________________
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________理由是_______________图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出![]() ,应该采用的分离方法最合理的是________。
,应该采用的分离方法最合理的是________。
二、合成叠氮化钠(![]() )晶体
)晶体
已知:相关物质的物理性质如下表
熔点℃ | 沸点℃ | 溶解性 | |
| -97 | 67.1 | 与水互溶 |
水合肼( | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯( | -17 | -12 | 溶于乙醇、乙醚 |
NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________。(写出1点即可)
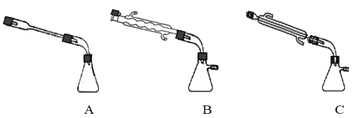
②图中![]() 处连接的最合适装置应为下图中的__________。
处连接的最合适装置应为下图中的__________。
③步骤Ⅱ中制备叠氮化钠的操作是________(填序号)步骤Ⅲ中溶液![]() 进行蒸馏的合理操作顺序是_______。(填序号)
进行蒸馏的合理操作顺序是_______。(填序号)
①打开![]() ,关闭
,关闭![]() ②打开
②打开![]() ③加热 ④关闭
③加热 ④关闭![]()
(4)步骤Ⅳ对溶液![]() 加热蒸发至溶液体积的
加热蒸发至溶液体积的![]() ,
,![]() 结晶析出。步骤Ⅴ可以用________洗涤晶体。
结晶析出。步骤Ⅴ可以用________洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
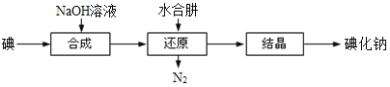
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________。