题目内容
现有下列两个图象:
下列反应中符合上述图象的是( )
A.N2(g) + 3H2(g) 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 2SO2(g) + O2(g) ΔH>0 2SO2(g) + O2(g) ΔH>0 |
C.4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) ΔH<0 4NO(g) + 6H2O(g) ΔH<0 |
D.H2(g) + CO2(g)  CO(g) + H2O(g) ΔH>0 CO(g) + H2O(g) ΔH>0 |
B
解析试题分析:从图Ⅰ可知,升高温度,生成物浓度增大,即平衡向正反应方向移动,说明正反应为吸热反应;从图Ⅱ可知,压强增大,v(逆)>v(正),即平衡向逆反应方向移动,说明逆反应为气体分子数减小的反应,同时满足以上两个条件的只有B选项。
考点:考查化学平衡移动、化学平衡图像的分析与应用。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
T℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H="-49.0" kJ/mol
CH3OH(g)+H2O(g) △H="-49.0" kJ/mol
测得H2和CH3OH(g)的浓度随时间变化情况如下图所示。下列说法不正确的是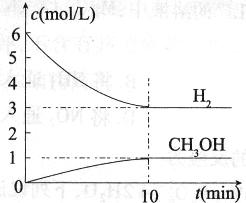
A.0~10 min内 (H2)="0.3" mol/(L·min) (H2)="0.3" mol/(L·min) |
| B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等 |
| C.T℃时,反应中当有32 g CH3OH生成时,放出49.0 kJ的热量 |
| D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
在体积恒定的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:
2SO2+O2 2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D.该反应过程中转移了2mol电子 |
T1℃时,向容积为2 L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
决定化学反应速率的根本因素是( )
| A.温度和压强 | B.反应物的浓度 | C.反应物的性质 | D.催化剂 |
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:
3A(g) + B(g)  2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( )
| A.X=2 |
| B.平衡时混合气体密度增大 |
| C.平衡时B的浓度为1.5 mol·L-1 |
| D.当A与B的正反应速率为3:1时该反应达到平衡 |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 ΔH>0)
2NO2 ΔH>0)
(a)将两容器置于沸水中加热(b)在活塞上都加2 kg的砝码
(b)在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )