��Ŀ����
T��ʱ����1 L���ܱ������г���2 mol CO2��6 mol H2��һ�������·�����Ӧ��
CO2��g��+3H2��g�� CH3OH��g��+H2O��g�� ��H="-49.0" kJ/mol
CH3OH��g��+H2O��g�� ��H="-49.0" kJ/mol
���H2��CH3OH��g����Ũ����ʱ��仯�������ͼ��ʾ������˵������ȷ����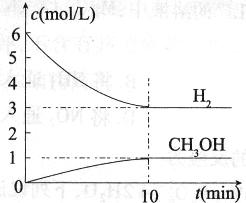
A��0��10 min�� ��H2��="0.3" mol/��L��min�� ��H2��="0.3" mol/��L��min�� |
| B��T��ʱ��ƽ�ⳣ��K=1/27��CO2��H2��ת������� |
| C��T��ʱ����Ӧ�е���32 g CH3OH����ʱ���ų�49.0 kJ������ |
| D���ﵽƽ��������¶Ȼ��ٳ���CO2���壬���������H2��ת���� |
D
�������������A��0��10min��H2�����ʵ�����6mol��СΪ3mol������v��H2��= =0.3mol/��L��min������A��ȷ�� B��ƽ��ʱc��H2��=3mol��L��1��c��CO2��=1mol��L��1��c��CH3OH��=1mol��L��1��c��H2O��=1mol��L��1������ƽ�ⳣ��K=
=0.3mol/��L��min������A��ȷ�� B��ƽ��ʱc��H2��=3mol��L��1��c��CO2��=1mol��L��1��c��CH3OH��=1mol��L��1��c��H2O��=1mol��L��1������ƽ�ⳣ��K= =
= ��CO2��H2��ת���ʾ�Ϊ50%����B��ȷ��C����ͼ��֪��ƽ��ʱ����1molCH3OH���ų�����Ϊ49kJ��64gCH3OH�����ʵ���Ϊ
��CO2��H2��ת���ʾ�Ϊ50%����B��ȷ��C����ͼ��֪��ƽ��ʱ����1molCH3OH���ų�����Ϊ49kJ��64gCH3OH�����ʵ���Ϊ =2mol�����Էų�98.0kJ����������C��ȷ��D����H��0�������¶ȣ�ƽ�������ƶ���H2��ת���ʼ�С����ƽ����ٳ���CO2���壬ƽ�������ƶ����������H2��ת���ʣ���D����
=2mol�����Էų�98.0kJ����������C��ȷ��D����H��0�������¶ȣ�ƽ�������ƶ���H2��ת���ʼ�С����ƽ����ٳ���CO2���壬ƽ�������ƶ����������H2��ת���ʣ���D����
���㣺�������ʵ�����Ũ����ʱ��ı仯���ߣ���ѧƽ��ļ��㡣

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д���10 L�ܱ������У�1 mol A��3 mol B��һ�������·�Ӧ��A��������xB������ 2C��������2min��Ӧ�ﵽƽ��ʱ����û�����干3��4 mol������0��4 mol C�������м���������ȷ���ǣ� �� ��
2C��������2min��Ӧ�ﵽƽ��ʱ����û�����干3��4 mol������0��4 mol C�������м���������ȷ���ǣ� �� ��
| A��ƽ��ʱ�����ʵ�����A��B��C��2��11��4 |
| B��xֵ����4 |
| C��B��ƽ����Ӧ����Ϊ0��04 mol��L-1��min-1 |
| D��A��ת����20�� |
���淴ӦaA(g)+bB(g) cC(g)+dD(s)����H=QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����
cC(g)+dD(s)����H=QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����
| A��T1��T2��Q��0 |
| B������ѹǿ��B��ת���ʼ�С |
| C������Ӧ��ƽ��ʱ�����������ܶȲ��ٱ仯 |
| D��a+b��c+d |
���ĸ���ͬ�������н��кϳɰ��ķ�Ӧ��������������ͬʱ���ڲⶨ�Ľ�����ж����ɰ�������������
| A��v (N2)=0��05mol��L��1��s��1 | B��v (H2)=0��3mol��L��1��min��1 |
| C��v (N2)=0��2 mol��L��1��min��1 | D��v (NH3)=0��3 mol��L��1��min��1 |
���ܱ������A��B��Ӧ����C���䷴Ӧ���ʷֱ��� ��
�� ��
�� ��ʾ����֪2
��ʾ����֪2 =3
=3 ��3
��3 =2
=2 ����˷�Ӧ�ɱ�ʾΪ
����˷�Ӧ�ɱ�ʾΪ
| A��2A+3B=2C | B��A+3B=2C | C��3A+B=2C | D��A+B=C |
�����й�˵����ȷ���� �� ��
| A���ϳɰ���Ӧ��ʹ�ô�����˵���������Դٽ���ƽ�������ɰ��ķ����ƶ� |
| B�������£���pH =10�İ�ˮϡ�ͣ���Һ����������Ũ�ȶ���С |
| C��100 mL pH��3��HA��HB�ֱ���������п��Ӧ,HA�ų���������,˵��HA���Ա�HB�� |
D����֪  I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
��һ�̶��ݻ����ܱ������У����淴Ӧ�� H2(g) + I2(g) 2HI (g)�ﵽƽ��ı�־��
2HI (g)�ﵽƽ��ı�־��
| A��H2��I2��HI�ķ�����֮��Ϊ1��1��2 |
| B������������ɫ���ٷ����仯 |
| C����λʱ������n mol H2��ͬʱ���ij�2n mol HI |
| D�����������ܶȱ��ֲ��� |
������������ͼ��
���з�Ӧ�з�������ͼ�����(���� )
A��N2(g) �� 3H2(g) 2NH3(g)�� ��H��0 2NH3(g)�� ��H��0 |
B��2SO3(g) 2SO2(g) �� O2(g)����H��0 2SO2(g) �� O2(g)����H��0 |
C��4NH3(g) �� 5O2(g) 4NO(g) �� 6H2O(g)����H��0 4NO(g) �� 6H2O(g)����H��0 |
D��H2(g) �� CO2(g)  CO(g) �� H2O(g)����H��0 CO(g) �� H2O(g)����H��0 |
 2C��˵�����±�ʾ�Ļ�ѧ��Ӧ����������
2C��˵�����±�ʾ�Ļ�ѧ��Ӧ����������