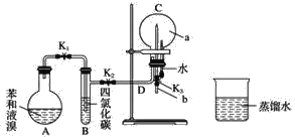
题目内容
【题目】有关如图所示原电池的说法正确的是
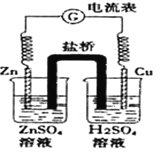
A. 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降
B. 盐桥的作用是让电子通过,以构成闭合回路
C. 随着反应进行,右烧杯中溶液pH变小
D. 总反应为:2H++ Zn ="==" H2↑+ Zn2+△H>0
【答案】A
【解析】
A.锌做负极,铜片做正极,电子从负极流向正极,负极:Zn - 2e-=Zn2+,正极:2H++2e-= H2↑, A正确;
B.盐桥中的阴离子向硫酸锌溶液中迁移B错误;
C. 右烧杯中2H++2e-= H2↑,PH增大,C错误;
D.只有放热的氧化还原反应才能设计成原电池,所以总反应为:2H++ Zn = H2↑+ Zn2+△H<0,D错误;
选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目