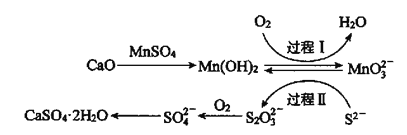
题目内容
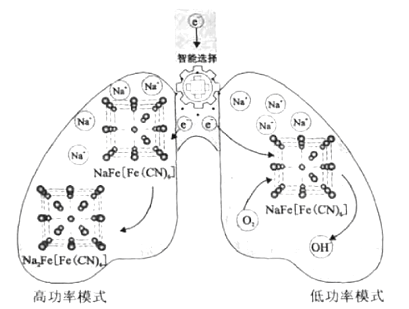
【题目】为满足可穿戴柔性电子设备(如二维手表带状柔性电池)的需求,我国科研团队研制出一种基于有机物电极材料芘四酮(PTO)和锌盐溶液作为电解液组装成的水系锌电池。原理如图所示。下列说法错误的是( )
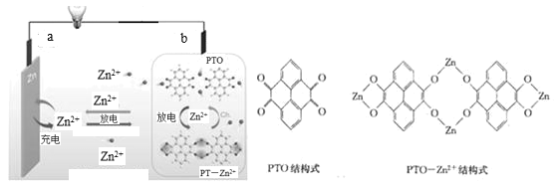
A.充电时,b接外接电源的负极
B.利用以上原理做成的柔性电池除优异的电化学性能外,还具备良好的弯曲性
C.充电时,每生成1molPTO,a电极增重260g
D.放电时,b极的电极反应式为![]()
【答案】AC
【解析】
放电时,阳离子移向正极,阴离子移向负极,金属Zn失电子生成Zn2+,即a电极为负极,b电极为正极,充电时外接电源的正极连接原电池的正极b,此时b电极为阳极,外接电源的负极连接原电池的负极a,此时a电极作阴极。
A.由分析可知,充电时,b接外接电源的正极,A错误;
B.由题意可知,该电池为可穿戴柔性电子设备(如二维手表带状柔性电池),具有良好的弯曲性,B正确;
C.充电时,b电极为阳极,阳极发生氧化反应,电极反应式为PTO—Zn2+-8e-=2PTO+4Zn2+;a电极为阴极,阴极发生还原反应,电极反应式为Zn2++2e-=Zn,根据电子守恒, PTO—2Zn,所以每生成1molPTO,a电极增重的质量为65g/mol×2mol=130g,C错误;
D.放电时,电极b为正极,正极发生还原反应,其反应式为2PTO+8e-+4Zn2+=PTO—Zn2+,D正确;
答案选AC。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
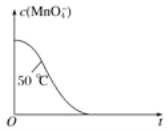
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水