题目内容
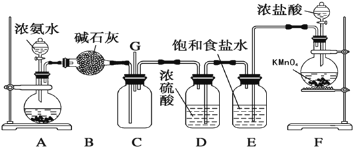
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________.(提示,高锰酸钾的还原产物为Mn2+)
(2)盛放浓盐酸的装置的名称是___________;A装置中的固体可能是____________.
(3)通入C装置的两根导管左边较长、右边较短,目的是________________________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:__________________________________.
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 分液漏斗 碱石灰或生石灰等 使密度大的氯气与密度小的氨气较快地均匀混合 3Cl2+8NH3═N2+6NH4Cl
【解析】
(1)F中发生高锰酸钾与浓盐酸的氧化还原反应,生成氯化钾、氯化锰、氯气、水;
(2)利用碱石灰与浓氨水可制取氨气;
(3)左边进入的为氨气,右边进入的为氯气,密度不同;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,以此来解答;
(1)F中发生高锰酸钾与浓盐酸的氧化还原反应,生成氯化钾、氯化锰、氯气、水,离子反应为2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O,因此,本题正确答案是:2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;
(2)盛放浓盐酸的装置的名称是分液漏斗;碱石灰或生石灰等与浓氨水混合可制取氨气,因此,本题答案为:分液漏斗;碱石灰或生石灰等;
(3)左边进入的为氨气,右边进入的为氯气,密度不同,则导管左边较长、右边较短使密度大的氯气与密度小的氨气较快地均匀混合,因此,本题答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,因此,本题正确答案是:3Cl2+8NH3═N2+6NH4Cl;

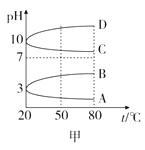
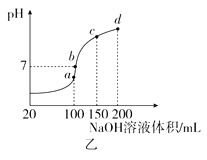
【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: ![]() H=-213.5kJ/mol,达到平衡时的数据如下:
H=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T12
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
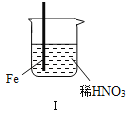
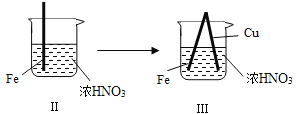
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化