题目内容
4.过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下: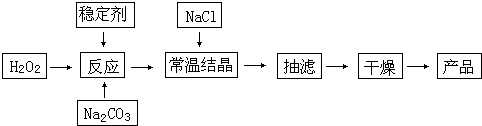
试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是强氧化性,下列四种物质可使过碳酸钠较快失效的是ABC
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是降低2Na2CO3•3H2O2溶解度,析出更多晶体
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是催化双氧水的分解,反应方程式为2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是温度高时双氧水易分解,温度偏低时造成产率偏低的可能原因是温度低时反应慢,而该流程中还是遗漏了一步操作,造成产品产率偏低,这步操作名称是洗涤.
(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为1mol/L(已知:H2O2+2HBr=Br2+2H2O)
分析 (1)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,具有强氧化性;二氧化锰能够做催化剂,促进双氧水分解;硫化氢具有还原性,能够与固体双氧水反应;稀硫酸能够与碳酸钠反应;碳酸氢钠不与固体双氧水反应;
(2)根据饱和溶液中的溶解平衡进行分析;
(3)铁离子能够做催化剂,促进双氧水的分解;
(4)双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作;
(5)溴化氢被消耗的物质的量分为两部分,一部分是生成二氧化碳消耗的,另一部分是与双氧水反应了氧化还原反应消耗,计算出溴化氢的物质的量,就可以计算出溴化氢的物质的量浓度.
解答 解:(1)由于过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,具有碳酸钠和双氧水的双重性质,
A、二氧化锰能够做催化剂,促进双氧水分解,使固体双氧水失效,故A正确;
B、硫化氢具有还原性,能够与固体双氧水反应,使固体双氧水失效,故B正确;
C、稀硫酸能够与碳酸钠反应,使固体双氧水失效,故C正确;
D、碳酸氢钠与固体双氧水不反应,不会使固体双氧水失效,故D错误;
所以正确的有ABC,
故答案为:强氧化性; ABC;
(2)加入了氯化钠,溶液中钠离子浓度增大,降低了固体双氧水的溶解度,会析出更多晶体,
故答案为:降低2Na2CO3•3H2O2溶解度,析出更多晶体;
(3)铁离子能够做催化剂,促进双氧水的分解,反应方程式为:2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑,
故答案为:催化双氧水的分解;2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑;
(4)由于双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作,
故答案为:温度高时双氧水易分解; 温度低时反应慢;洗涤;
(5)二氧化碳的物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据关系式:Na2CO3~CO2~2HBr,
生成二氧化碳消耗的溴化氢:n(HBr)=2×n(CO2)=0.04mol,
碳酸钠的物质的量为0.02mol,根据化学式2Na2CO3•3H2O2含有双氧水物质的量为:0.03mol,
根据反应H2O2+2HBr=Br2+2H2O,双氧水氧化的溴化氢物质的量为:0.03×2=0.06mol,
溴化氢总的物质的量为:0.04mol+0.06mol=0.1mol,
溴化氢的浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1.
点评 本题考查了固体双氧水过碳酸钠(2Na2CO3•3H2O2)的制取方法,涉及内容较多,充分考查了学生的综合能力,本题难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | Cl2+2I-═2Cl-+I2 | B. | 稳定性:HCl>HI | ||
| C. | 酸性 HClO4>HIO4 | D. | 酸性 HClO3>HIO3 |

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为KCl、Cl2;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是降温结晶.
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是$\frac{0.01}{3w}$mol•kg-1(以含w的代数式表示).
②学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,甲3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol.L-1的H2SO4,从发振荡 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:偏大,过量的I-会被空气中的O2氧化为I2.
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是Mg2+.
②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O.
| A. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是一个放出热量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,2SO2+O2?2SO3是一个放热反应,则2SO3?2SO2+O2是一个吸热反应 | |
| D. | 73 g氯化氯具有的能量大于2 g氢气和71 g氯气具有的总能量 |
| A. | 加入蒸馏水 | B. | 加热 | C. | 加入NaHSO4固体 | D. | 加入浓盐酸 |
| A. | 微量元素虽然含量占人体的0.01以下,但对于维持生命活动,促进健康和发育却有极其重要的作用 | |
| B. | 钙元素属于微量元素 | |
| C. | 青少年或成人缺碘可引起甲状腺肿大 | |
| D. | 摄入的铁越多越利于身体健康 |
| A. | 硫酸>磷酸>高氯酸 | B. | 硫酸>高氯酸>磷酸 | ||
| C. | 高氯酸>硫酸>磷酸 | D. | 高氯酸>磷酸>硫酸 |
 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: