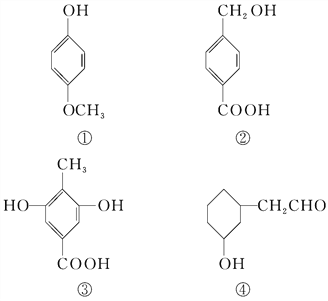
题目内容
【题目】写出铝丝与硫酸铜溶液的化学方程式,并用双线桥标出电子的转移。化学方程式: _______________;氧化剂:__________ ,还原剂: __________,氧化产物:___________ ,还原产物:________。
【答案】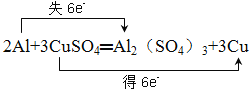 CuSO4 Al Al2(SO4)3 Cu
CuSO4 Al Al2(SO4)3 Cu
【解析】
铝的金属活动性强于铜,其能将硫酸铜溶液中的铜置换出来,结合元素化合价的变化分析解答。
铝与硫酸铜溶液反应的化学方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu,2Al+3CuSO4═Al2(SO4)3+3Cu↑反应中Cu元素化合价由+1价变为0价、Al元素化合价由0价变为+3价,电子转移用双线桥表示为 ;失电子化合价升高的反应物是还原剂、得电子化合价降低的反应物是氧化剂,氧化剂对应的产物是还原产物、还原剂对应的产物是氧化产物,所以还原剂是Al、氧化剂是CuSO4、还原产物是Cu、氧化产物是Al2(SO4)3,故答案为:
;失电子化合价升高的反应物是还原剂、得电子化合价降低的反应物是氧化剂,氧化剂对应的产物是还原产物、还原剂对应的产物是氧化产物,所以还原剂是Al、氧化剂是CuSO4、还原产物是Cu、氧化产物是Al2(SO4)3,故答案为: ;CuSO4;Al;Al2(SO4)3;Cu。
;CuSO4;Al;Al2(SO4)3;Cu。

【题目】回答下列问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式_________________________。
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) ![]() 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl- Cl | Cl-N | N=O |
键能/kJ·mol-1 | 630 | 243 | a | 607 |
则2NO(g)+C12(g) ![]() 2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。