��Ŀ����
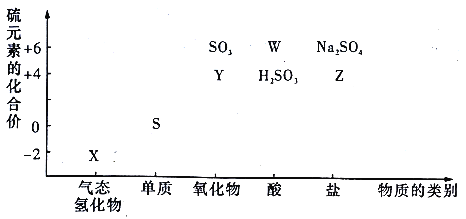
����Ŀ��������ͼװ����ȡClO2 �� ����ClO2Ϊԭ���Ʊ��������ƣ�NaClO2��һ�ָ�Ч��������Ư��������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl�� 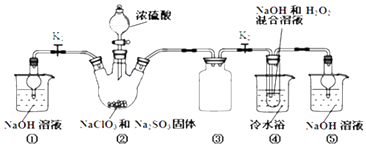
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��2��װ�â۵���������װ�âٺ͢��ڱ�ʵ���е����� ��
��3��װ�âܷ�Ӧ�����Һ�л���������NaOH���ʣ��Ӹ���Һ�����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�����������ᾧ���ڳ��ȹ��ˣ�����50�����ҵ���ˮϴ�ӣ��ܵ���60�����õ���Ʒ�����������50�����ҵ���ˮϴ�ӵ�ԭ���� ��
��4���������ƴ��Ȳⶨ����ȷ��ȡ��������������Ʒ10.0g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250mL������Һ����ȡ25.00mL����Һ����2.0 molL��1Na2S2O3��Һ�ζ���I2+2S2O32��=2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ �� �ظ��ζ�3�Σ�������������ʾ�������Ʒ��NaClO2����������Ϊ ��
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
��5��ʵ���������NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ȡ������NaClO2 �� ����һ�ݼ��ȸ���60��ʹ֮���ʣ���һ���ϸ棬�������Һ�����ֱ�������FeSO4��Һ��Ӧʱ������Fe2+�����ʵ��������ͬ��������ͬ�������жϡ�����
���𰸡�
��1��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2��
��2����ֹ���������շ�Ӧ���������壬��ֹ����Ⱦ����
��3����ֹ����NaClO2?3H2O������¶ȹ��߲�Ʒ�ֽ�
��4��������һ�α�Һ����ƿ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%
��5����ͬ
���������⣺��1�����ݷ�Ӧ��NaClO3��Na2SO3��H2SO4 �� ������ΪClO2��2Na2SO4 �� ��ƽ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��װ�âܷ�Ӧ���NaClO2 �� ��ӦΪ��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2�������Դ��ǣ�2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2������2��װ�â�Ϊ��ȫƿ����ֹװ�â��������¶Ƚ��Ͷ�����������װ�âٺ͢����շ�Ӧ���������壬��ֹ����Ⱦ���������Դ��ǣ���ֹ���������շ�Ӧ���������壬��ֹ����Ⱦ��������3����ΪNaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl����Ҫ�õ�NaClO2���壬����38��60��õ����壬��38��60�����ˮϴ�ӣ���ֹ����NaClO23H2O������¶ȹ��߲�Ʒ�ֽ⣬���Դ��ǣ���ֹ����NaClO23H2O������¶ȹ��߲�Ʒ�ֽ⣻��4���ⵥ�ʲκ����ɵķ�Ӧ��һ����õ�����Һ��ָʾ�����÷�Ӧ��Na2S2O3��Һ�ζ��⣬�������һ��Na2S2O3��Һ���յ���Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��3�β�����������������������Ƶ�����ǣ� ![]() =20.77mL��
=20.77mL��
����ʱһ���ҳ���ϵʽ���ɴ˽��м��㣬��ϵʽΪClO2������2I2����4S2O32��
n��ClO2����= ![]() n��S2O32����=
n��S2O32����= ![]() ��20.77��10��3��2.0��0.01mol,
��20.77��10��3��2.0��0.01mol,
m��NaClO2��=0.01��90.5=9.05g������õ���Ʒ��NaClO2����������= ![]() ��100%=90.5%�����Դ��ǣ��������һ��Na2S2O3��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%����5��NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ClԪ�ش�+3�۱�Ϊ+5�ۺͩ�1�ۣ���ӦΪ3NaClO2=2NaClO3+NaCl��NaClO2����������FeSO4��Һ��Ӧ3ClO2��+12Fe2++6H2O=4Fe��OH��3��+3Cl��+8Fe3+ �� ���յõ�ClԪ����+3�۱�Ϊ��1�ۣ�����NaClO2����ǰ��ֱ���Fe2+��Ӧʱ�����վ��õ�����NaCl��ClԪ�ؾ���+3�۱�Ϊ��1�ۣ����ݵ����غ㣬���������еõ��ĵ��ӵ����ʵ�����ͬ������������������FeSO4�����ʵ�����ͬ�����Դ��ǣ���ͬ��
��100%=90.5%�����Դ��ǣ��������һ��Na2S2O3��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%����5��NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ClԪ�ش�+3�۱�Ϊ+5�ۺͩ�1�ۣ���ӦΪ3NaClO2=2NaClO3+NaCl��NaClO2����������FeSO4��Һ��Ӧ3ClO2��+12Fe2++6H2O=4Fe��OH��3��+3Cl��+8Fe3+ �� ���յõ�ClԪ����+3�۱�Ϊ��1�ۣ�����NaClO2����ǰ��ֱ���Fe2+��Ӧʱ�����վ��õ�����NaCl��ClԪ�ؾ���+3�۱�Ϊ��1�ۣ����ݵ����غ㣬���������еõ��ĵ��ӵ����ʵ�����ͬ������������������FeSO4�����ʵ�����ͬ�����Դ��ǣ���ͬ��

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�