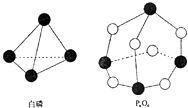
��Ŀ����
����Ŀ���Ͼ���ʾ�������к���SiO2��Fe2O3��CeO2��FeO�����ʣ�ij����С���Դ˲�����ĩΪԭ�ϣ��Ƶ�Ce��OH��4��������立�������������£� 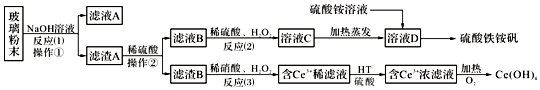
��֪�������������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��Ce4+�н�ǿ�����ԣ�
��CeO2������ϡ���ᣬҲ����������������Һ��
�ش��������⣺
��1�������ٵ����������ò������õIJ��������У��ձ����� ��
��2����Ӧ��2���й�������������ǣ� ��
��3����Ӧ��3�������ӷ���ʽ�ǣ�
��4����֪�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+��ˮ�㣩+6HT���л��㣩2CeT3���л��㣩+6H+��ˮ�㣩��ƽ��ǶȽ��ͣ���CeT3���л��㣩���������ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ���� ��
��5��������立��㷺����ˮ�ľ����������侻ˮԭ�������ӷ���ʽ��ʾΪ��
��6����ͬ���ʵ���Ũ�ȵ�����������Һ�У�笠�����Ũ���ɴ�С��˳���ǣ� ��
a��xFe2��SO4��3y��NH4��2SO4zH2Ob����NH4��2SO4c����NH4��2CO3d��NH3H2O
��7��Ϊ�ⶨij������立���Ʒ����ɣ��ֳ�ȡ14.00g����Ʒ����������ˮ���Ƴ�100mL��Һ���ٽ���Һ�ֳ����ȷݣ�������һ�ݼ�����������������Һ�����ˡ�ϴ�ӳ������ٺ�����������أ��õ�1.60g���壻����һ����Һ�м���0.5mol/L���ᱵ��Һ100mL��ǡ����ȫ��Ӧ�����������立��Ļ�ѧʽΪ ��
���𰸡�
��1�����ˣ�©����������
��2������ʹFe2+ת��ΪFe3+
��3��2GeO2+6H++H2O2=2Ge3++4H2O+O2��
��4�����Һ�м���H2SO4ʹc��H+������ƽ�����γ�Ge3+ˮ��Һ�����ƶ�
��5��Fe3++3H2O=Fe��OH��3�����壩+3H+
��6��a��b��c��d
��7��Fe2��SO4��3?2��NH4��2SO4?2H2O
���������⣺�ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A��Fe2O3��CeO2��FeO����ϡ�������˵���ҺB������������Һ��������������������������������ҺC��Ϊ�������������������������ⲻ���������ʣ����������õ���ҺDΪ������������Һ������Һ�м����������Һ�õ�������立�������B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2 �� ����HT������ȡ����Ce3+��ˮ��Һ����ȡ������Ce3+�Ӽ����������������ԭ��Ӧ����Ce��OH��4 �� ��1��ͨ�������ٵõ���������Һ���������Ϊ���ˣ�������Ҫ�IJ����������ձ�����������©�������Դ��ǣ����ˣ�©��������������2����Ӧ����H2O2������������ʹ��������Ϊ�����ӣ�
���Դ��ǣ�����ʹFe2+ת��ΪFe3+����3����Ӧ����������Һ��CeO2���������ԭ����Ce3+���ӣ��������ⱻ����������������Ӧ�����ӷ���ʽ2GeO2+6H++H2O2=2Ge3++4H2O+O2����
���Դ��ǣ�2GeO2+6H++H2O2=2Ge3++4H2O+O2������4���л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+��ˮ�㣩+6HT���л��㣩�T2CeT3���л��㣩+6H+��ˮ�㣩��������������������Ũ�ȣ�ƽ������������γ�Ge3+ˮ��Һ�����ƶ�����ýϴ��ĺ�Ce3+��ˮ��Һ��
���Դ��ǣ����Һ�м���H2SO4ʹc��H+������ƽ�����γ�Ge3+ˮ��Һ�����ƶ�����5��������立�[Fe2��SO4��3��NH4��2SO424H2O]�㷺����ˮ�ľ����������侻ˮԭ�����ܽ����Һ�е�������ˮ�����������������壬������������������ʵ����ã����Ծ�ˮ����Ӧ�����ӷ���ʽΪ��Fe3++3H2O=Fe��OH��3�����壩+3H+��
���Դ��ǣ�Fe3++3H2O=Fe��OH��3�����壩+3H+����6����ͬ���ʵ���Ũ�ȵ�����������Һ�У�
a��xFe2��SO4��3y��NH4��2SO4zH2O ��Һ��������ˮ������������笠�����ˮ�⣬笠�����Ũ������
b����NH4��2SO4 ��Һ����������Ӷ�笠�����ˮ����Ӱ�죻
c����NH4��2CO3 �� ��Һ��̼�������ˮ���Լ��Դٽ�笠�����ˮ�⣬笠�����Ũ�ȼ�С��
d��NH3H2O�����������笠�����Ũ����С��
���Դ��ǣ�a��b��c��d����7����ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�������������������صõ�1.60g����Ϊ��������n��Fe2O3��= ![]() =0.01mol���������������������ʵ���Ϊ��n��Fe��OH��3��=0.02mol��
=0.01mol���������������������ʵ���Ϊ��n��Fe��OH��3��=0.02mol��
����һ����Һ�м���0.05mol Ba��NO3��2��Һ��ǡ����ȫ��Ӧ����n��SO42����=0.05mol��
����14.00g��Ʒ�к���Fe2��SO4��30.02mol��n��SO42����Ϊ0.1mol����NH4��2SO4Ϊ0.1mol��0.02mol��3=0.04mol��
��m��H2O��=14.00g��0.02mol��400g/mol��0.04mol��132g/mol=0.72g��n��H2O��= ![]() =0.04mol��
=0.04mol��
��n��Fe2��SO4��3����n����NH4��2SO4����n��H2O��=0.02��0.04��0.04=1��2��2��
���Ի�ѧʽΪFe2��SO4��32��NH4��2SO42H2O��
���Դ��ǣ�Fe2��SO4��32��NH4��2SO42H2O��

 һ����������ϵ�д�
һ����������ϵ�д�����Ŀ��������ͼװ����ȡClO2 �� ����ClO2Ϊԭ���Ʊ��������ƣ�NaClO2��һ�ָ�Ч��������Ư��������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl�� 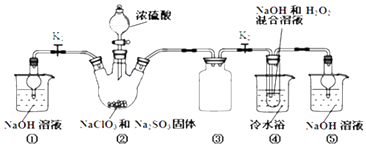
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��2��װ�â۵���������װ�âٺ͢��ڱ�ʵ���е����� ��
��3��װ�âܷ�Ӧ�����Һ�л���������NaOH���ʣ��Ӹ���Һ�����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�����������ᾧ���ڳ��ȹ��ˣ�����50�����ҵ���ˮϴ�ӣ��ܵ���60�����õ���Ʒ�����������50�����ҵ���ˮϴ�ӵ�ԭ���� ��
��4���������ƴ��Ȳⶨ����ȷ��ȡ��������������Ʒ10.0g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250mL������Һ����ȡ25.00mL����Һ����2.0 molL��1Na2S2O3��Һ�ζ���I2+2S2O32��=2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ �� �ظ��ζ�3�Σ�������������ʾ�������Ʒ��NaClO2����������Ϊ ��
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
��5��ʵ���������NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ȡ������NaClO2 �� ����һ�ݼ��ȸ���60��ʹ֮���ʣ���һ���ϸ棬�������Һ�����ֱ�������FeSO4��Һ��Ӧʱ������Fe2+�����ʵ��������ͬ��������ͬ�������жϡ�����