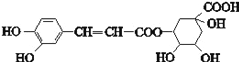题目内容
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:___________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_____________;
(2)实验中判断沉淀是否完全的方法是_______________________。
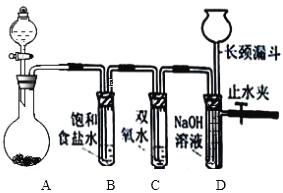
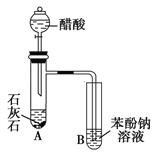
方案三:按如图装置进行实验:
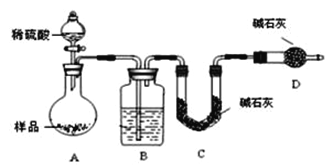
(1)B装置内所盛试剂是_________;D装置的作用是_______;分液漏斗中_______(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:_____。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑保证NaHCO3分解完全玻璃棒取少量上层清液于试管中,滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成浓硫酸防止空气中的水蒸气、CO2进入C装置不能70.4%(70%)缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置(或其他合理答案)
Na2CO3+H2O+CO2↑保证NaHCO3分解完全玻璃棒取少量上层清液于试管中,滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成浓硫酸防止空气中的水蒸气、CO2进入C装置不能70.4%(70%)缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置(或其他合理答案)
【解析】
[方案一]碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数;
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(2)加热恒重保证碳酸氢钠完全分解;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数;
(1)根据过滤操作考虑所需仪器;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀;
[方案三](3)由测定含量的实验可以知道,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+ H2SO4=2H2O+2CO2↑+Na2SO4,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定;
(4)结合反应定量关系和元素守恒计算得到物质的质量,来计算物质含量;
(5)二氧化碳气体不能全部进入C装置被吸收,需要添加一个将二氧化碳气体赶入装置C的装置。
[方案一](1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为: 2NaHCO3![]() Na2CO3+H2O+CO2↑;正确答案:2NaHCO3
Na2CO3+H2O+CO2↑;正确答案:2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解;因此,本题正确答案是: 保证NaHCO3分解完全。
[方案二](1)过滤时需用玻璃棒引流;因此,本题正确答案是:玻璃棒。
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,因此,本题正确答案是: 取少量上层清液于试管中,滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成。
[方案三](1)B中为浓硫酸吸收水,干燥二氧化碳,空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小;因此,本题正确答案是:浓硫酸;防止空气中的水蒸气、二氧化碳进入C装置;不能。
(2)设Na2CO3和NaHCO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4
1 1
x x
2NaHCO3+ H2SO4=2H2O+2CO2↑+Na2SO4
2 2
Y y
根据上述条件解方程:106x+84y=17.90,,44x+44y=8,80,计算得出x=0.05mol , y=0.15mol,则样品中NaHCO3的质量分数为=0.15×84/17.9×100%= 70.4%;因此,本题正确答案是:70.4%(70%)。
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收;因此,本题正确答案是:缺少一套将A、B装置内的 CO2气体驱赶到C装置中的装置。

 中考解读考点精练系列答案
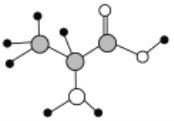
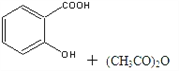
中考解读考点精练系列答案【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
![]()

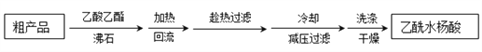
制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____________________。
(2)合成阿司匹林时,最合适的加热方法是_________________________。
(3)提纯粗产品流程如下,加热回流装置如图:
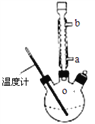
①使用温度计的目的是是控制加热的温度,防止_____________________________。
②冷凝水的流进方向是______________(填“a”或“b”);
③趁热过滤的原因是_________________________________________________。
④下列说法正确的是__________(填选项字母)。
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 ___________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 ___________(用百分数表示,小数点后一位)。