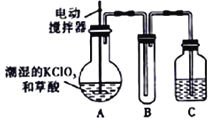
题目内容
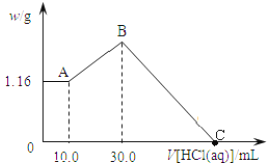
【题目】将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水, 产生1.16g白色沉淀, 再向所得浊液中逐渐加入1.00 mol/L的盐酸, 加入盐酸的体积与生成沉淀的关系如下图:
请回答:
①A点溶液中溶质有___________(填化学式);
②写出加入盐酸体积由10.0mL到30.0mL发生反应的离子方程式________________;
③原混合物中MgCl2质量是_________, AlCl3物质的量是________, NaOH质量是______。
④C点消耗盐酸的体积为___________mL。
【答案】NaOH, NaAlO2 AlO2- +H+ +H2O ==Al(OH)3 1.9g 0.02mol 5.2g 130
【解析】
将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水,产生1.16g白色沉淀,沉淀中一定含有氢氧化镁,再加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则溶液中铝离子完全转化为偏铝酸根离子,A点溶液中有NaOH和NaAlO2,A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,B-C过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠,据此分析解答。
①将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水,产生1.16g白色沉淀,沉淀中一定含有氢氧化镁,再加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,因此A点溶液中溶质有NaOH和NaAlO2,故答案为:NaOH和NaAlO2;
②加入盐酸体积由10.0mL到30.0mL,即A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,故答案为:H2O+AlO2-+H+=Al(OH)3↓;
③A点沉淀的是氢氧化镁,则n(Mg(OH)2)=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量=0.02mol×95g/mol=1.9g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝原子守恒得n(AlCl)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol氢氧化钠的质量=0.13mol×40g/mol=5.2g,故答案为:1.9g;0.02mol;5.2g;
=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量=0.02mol×95g/mol=1.9g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝原子守恒得n(AlCl)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol氢氧化钠的质量=0.13mol×40g/mol=5.2g,故答案为:1.9g;0.02mol;5.2g;
④C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量n(HCl)=n(NaOH)=0.13mol;C点所表示盐酸的体积为:V=![]() =0.13L=130mL,故答案为:130。
=0.13L=130mL,故答案为:130。

【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
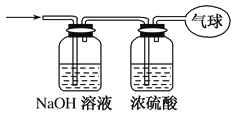
【题目】下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
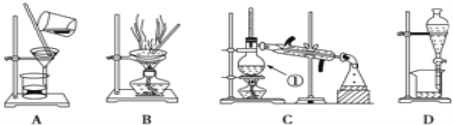
下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
(1)装置B中被加热仪器的名称是_____,装置C中①的名称是_________。
(2)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的操作是__________。加入Na2CO3溶液的目的是__________,所加入的试剂④是____________ (填化学式)。
(3)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
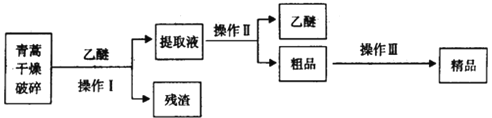
若要在实验室模拟上述工艺,操作I选择的实验操作是_____,操作Ⅱ选择的实验操作是_________。