题目内容
【题目】某研究性学习小组设计了一组实验来验证元素周期律。
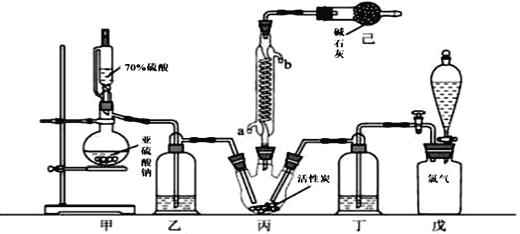
Ⅰ.甲同学用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入氢硫酸中。

(1)过氧化氢的电子式为________________。
(2)从图1中选择氧气的制备装置:________(填“A”或“B”),反应前需要进行的操作是___________。
(3)该实验如何证明O的非金属性强于S?________________________(用化学方程式表示)。
Ⅱ.乙同学利用图3所示实验装置设计实验来验证氮、碳、硅元素的非金属性强弱。已知A是一种强酸溶液,常温下可与铜反应;B是难溶性块状固体;打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。
(4)写出所选物质或溶液中溶质的化学式:A________,B________,C________。
【答案】![]() A检查装置的气密性O2+2H2S===2S↓+2H2OHNO3CaCO3Na2SiO3(答案合理即可)
A检查装置的气密性O2+2H2S===2S↓+2H2OHNO3CaCO3Na2SiO3(答案合理即可)
【解析】
Ⅰ.(1)过氧化氢的电子式为![]() 。(2)用过氧化氢的水溶液和二氧化锰制备氧气,反应物分别为液体和固体,且不需要加热,所以应该选择A装置;实验之前必须检查装置的气密性。 (3)一般元素的非金属性越强,其单质的氧化性越强,氧气能氧化硫化氢生成S,说明O的非金属性强于S,反应的化学方程式为O2+2H2S===2S↓+2H2O。Ⅱ.乙同学利用图3所示实验装置设计实验来验证氮、碳、硅元素的非金属性强弱。已知A是一种强酸溶液,常温下可与铜反应,说明A为硝酸;B是难溶性块状固体,应该为碳酸钙,利用硝酸和碳酸钙反应生成二氧化碳,证明硝酸的酸性比碳酸强,进而证明氮和碳的非金属性强弱;打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成,说明二氧化碳和某溶液反应生成沉淀,根据题目要求,烧杯中应为硅酸钠,反应后生成硅酸沉淀,证明碳酸的酸性比硅酸强,进而证明碳的非金属性比硅强。(4)根据以上分析可知A为硝酸,B为碳酸钙,C为硅酸钠。
。(2)用过氧化氢的水溶液和二氧化锰制备氧气,反应物分别为液体和固体,且不需要加热,所以应该选择A装置;实验之前必须检查装置的气密性。 (3)一般元素的非金属性越强,其单质的氧化性越强,氧气能氧化硫化氢生成S,说明O的非金属性强于S,反应的化学方程式为O2+2H2S===2S↓+2H2O。Ⅱ.乙同学利用图3所示实验装置设计实验来验证氮、碳、硅元素的非金属性强弱。已知A是一种强酸溶液,常温下可与铜反应,说明A为硝酸;B是难溶性块状固体,应该为碳酸钙,利用硝酸和碳酸钙反应生成二氧化碳,证明硝酸的酸性比碳酸强,进而证明氮和碳的非金属性强弱;打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成,说明二氧化碳和某溶液反应生成沉淀,根据题目要求,烧杯中应为硅酸钠,反应后生成硅酸沉淀,证明碳酸的酸性比硅酸强,进而证明碳的非金属性比硅强。(4)根据以上分析可知A为硝酸,B为碳酸钙,C为硅酸钠。

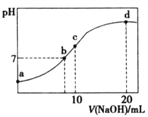
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

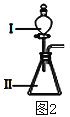
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。