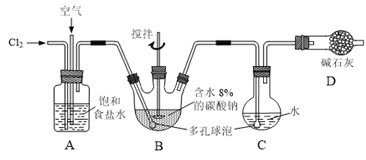
题目内容
【题目】在一定条件下1molC3H8发生如下反应:①C3H8→C2H4+CH4②C3H8→C3H6+H2如果C3H8的转化率为80%,且混合气体中m(CH4)=m(H2),则下列说法正确的是( )
A. 反应后混合气体的平均相对分子质量为35.2
B. 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶1
C. 将混合气体通入溴的四氯化碳溶液,溶液增重128g
D. 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol
【答案】D
【解析】1molC3H8发生反应,C3H8的转化率为80%,参加反应的C3H8是0.8mol;则混合气体含有n(C3H8)=0.2mol,由m(CH4)=m(H2)可知n(CH4)/n(H2)=1:8;所以生成氢气的物质的量是![]() ;反应后混合气体的平均相对分子质量为
;反应后混合气体的平均相对分子质量为![]() ,故A错误;两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶8,故B错误;将混合气体通入溴的四氯化碳溶液,溶液增重
,故A错误;两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶8,故B错误;将混合气体通入溴的四氯化碳溶液,溶液增重![]() 35g,故C错误;参加反应的C3H8是0.8mol,所以生成两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol,故D正确。
35g,故C错误;参加反应的C3H8是0.8mol,所以生成两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol,故D正确。

练习册系列答案
相关题目