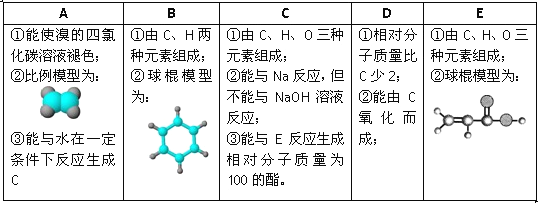
��Ŀ����
����Ŀ�����������£���һԪ��HA����Һ��KOH��Һ�������ϣ����Ի�Ϻ���Һ������仯����ʵ���������±���
ʵ����� | ��ʼŨ�ȣ���mol��L��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c��KOH�� | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
��ش�
��1��HA��Һ��KOH��Һ��Ӧ�����ӷ���ʽΪ________��
��2��ʵ������Ӧ�����Һ����ˮ�������c��OH������________mol��L��1��x________0.2mol��L��1����������������������������
��3�����й���ʵ������Ӧ�����Һ˵������ȷ����________������ĸ����
a����Һ��ֻ����������ƽ��
b����Һ�У�c��A������c��HA����0.1mol��L��1
c����Һ�У�c��K������c��A������c��OH������c��H����
������֪2H2��g����O2��g����2H2O��1�� ��H����572kJ��mol��1��ij����ȼ�ϵ�������ɶ��ʯī��Ϊ�缫��KOH��ҺΪ�������Һ��
��4��д���õ�ع���ʱ�����ĵ缫��Ӧʽ________��
��5����������ȼ�ϵ��ÿ�ͷ�228.8kJ����ʱ��������1molҺ̬ˮ����õ�ص�����ת����Ϊ________��
���𰸡� HA��OH����A����H2O 1��10��5 �� a H2��2OH����2e����2H2O 80��
������������(1)��Ũ�Ⱥ͵������HA��Һ��KOH��Һ��Ϻ���Һ�Լ��ԣ�˵��HAΪ���ᣬ��HA��Һ��KOH��Һ��Ӧ�����ӷ���ʽΪHA+OH����A����H2O��
(2)ʵ������Ӧ�����Һ��pH=9����Һ��OH-��Դ��ˮ����ˮ�������c(OH��)��![]() mol��L��1=1��10-5mol��L��1��������Ϊǿ�ᣬ�������Ũ�Ȼ��ʱpH=7����HAΪ���ᣬ�������Ũ�Ȼ����Һ��pH����7����Ϊ��֤pH=7��Ӧʹ��Ũ��Ӧ�ô���0.2mol/L��
mol��L��1=1��10-5mol��L��1��������Ϊǿ�ᣬ�������Ũ�Ȼ��ʱpH=7����HAΪ���ᣬ�������Ũ�Ȼ����Һ��pH����7����Ϊ��֤pH=7��Ӧʹ��Ũ��Ӧ�ô���0.2mol/L��
(3)a��ʵ������Ӧ����Һ��ֻ����HA�ĵ��롢ˮ�ĵ��뼰A-��ˮ��ƽ�⣬��a����b����Ũ�ȴ���0.2mol/L�����������غ�c(A��)��c(HA)��0.1mol��L��1����b��ȷ��c����Һ��pH=7����ϵ���غ�ɵ�c(K��)��c(A��)��c(OH��)��c(H��)����c��ȷ����Ϊa��
����(4)������ȼ�ϵ�صĸ����Ϸ���ʧ���ӵ�������Ӧ���� H2��2OH����2e����2H2O��
(5)H2(g)+![]() O2(g)=H2O(l)��H=-286KJmoL-1������ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ
O2(g)=H2O(l)��H=-286KJmoL-1������ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ![]() ��100%=80%��
��100%=80%��

 ��У����ϵ�д�
��У����ϵ�д�