题目内容
【题目】(1)将1.0 mol CH4和2.0molH2O(g)通入容积固定为10 L的反应容器中,在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。
CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。

①该反应的ΔH 0(填“>”“<”或“=”)
②假设100 ℃时达到平衡所需的时间为3 min,则用H2表示该反应的平均反应速率为 mol/(L·min)。
③100℃时该反应的平衡常数的数值为 。
④可用来判断该反应达到平衡状态的标志有 (填字母)。
A.CO的含量保持不变
B.CH4浓度与CO浓度相等
C.ν正(CH4)=3ν逆(H2)
D.混合气体的密度保持不变
E.混合气体的总物质的量保持不变
F.混合气体的压强度保持不变
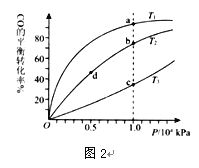
(2)生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
A.温度:T1>T2 > T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a)>K(c) ; K(b)=K(d)
D.平均摩尔质量:M(a) >M(c); M(b)>M(d)
(3)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) ![]() CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
【答案】(1) ① > ② 0.05 ③ 0.0225 ④ A EF(错选不得分,漏选得1分)
(2)C D(错选不得分,漏选得1分)
(3)该反应是一个熵增的反应 (△S>0)
【解析】
试题分析:(1)①随温度升高,CH4的转化率增大,说明平衡正向移动,正反应为吸热反应,此反应的△H>0;
②将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
③假设100℃时达到平衡所需的时间为3min,则用H2表示该反应的平均反应速率=![]() =0.05molL-1min-1;
=0.05molL-1min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.05mol/L,c(H2O)=0.15mol/L,c(CO)=0.05mol/L,c(H2)=0.15mol/L,平衡常数K=![]() =2.25×10-2;
=2.25×10-2;
④A.CO的含量保持不变可说明反应达平衡状态,正确;B.CH4浓度与CO浓度相等无法判断是否是平衡状态,错误;C.ν正(CH4)=ν逆(H2)才能说明是平衡状态,错误;D.混合气体的密度始终保持不变,无法判断是否是平衡状态,错误;E.混合气体的总物质的量保持不变说明此时已经达到平衡状态,正确;F.反应物和生成物的系数之和不等,混合气体的压强度保持不变说明此时已经达到平衡状态,正确;答案为AEF;
(2)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C正确;
D.CO转化率的越大,n总越小,由M=![]() 可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D正确;故选CD;
可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D正确;故选CD;
(3)甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)CO(g)+2H2(g),反应△H>0,反应自发进行需要满足△H-T△S<0,所以反应自发进行是因为该反应是熵增大的反应;

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案