题目内容
【题目】某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧。②常温下CO能与PdCl2溶液反应得到黑色的Pd。经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳、也可能是CO,氧化产物可能是Na2CO3。为验证上述推断,他们设计如下方案进行实验,请回答下列问题。
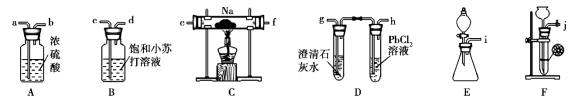
(1)他们欲用上述仪器组装一套装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验气态还原产物,所用仪器接口连接顺序为 ,制取CO2反应的离子方程式为 。
(2)装置连接好后,首先要进行的实验操作是 ,点燃酒精灯前,应进行的操作是 ,等装置 (填写装置字母代号及现象)时,再点燃酒精灯,这步操作的目的是 。
(3)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为 ;若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为 。
(4)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是 。
【答案】(1)jcdabefg(e与f可颠倒) CaCO3+2H+=Ca2++H2O+CO2↑
(2)检查装置的气密性 打开F中导管上的止水夹 D中澄清石灰水变浑浊 排尽装置内的空气
(3)2Na+2CO2=Na2CO3+CO 4Na+3CO2=2Na2CO3+C
(4)将残留固体溶于水,在所得水溶液中加入过量BaCl2溶液,再向溶液中滴加2滴酚酞试液,若溶液变红色,则残留固体中含有Na2O,否则不含Na2O
【解析】
试题分析:(1)装置F可通过关闭或打开导管上的止水夹实现对制气反应的控制,制取的CO2中含有HCl、H2O,可分别用饱和NaHCO3溶液、浓硫酸除去,因此所用仪器接口连接顺序为jcdabefg(e与f可颠倒)。制取CO2反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
(2) 装置连接好后,首先要进行的实验操作是检查装置的气密性;由于钠易与氧气反应,故点燃酒精灯前先用CO2将装置内空气排出,当澄清石灰水变浑浊时,表明装置中空气已排尽;
(3)当C中残留固体只有一种而D中的PdCl2溶液中有黑色沉淀时,表明反应的产物是Na2CO3与CO,反应的方程式为2Na+2CO2=Na2CO3+CO;当C中固体有两种而D中的PdCl2溶液中没有黑色固体出现时,表明生成物是Na2CO3与单质碳,相应的化学方程式为4Na+3CO2=2Na2CO3+C;
(4)氧化钠溶于水生成氢氧化钠,溶液显碱性,但碳酸钠溶于水也显碱性,会干扰检验,因此正确的实验操作是将C中残留固体溶于水,加过量钡盐除去C,再检验溶液是否呈碱性,若呈碱性,,则表明固体中有Na2O,否则不含Na2O。





