题目内容
6.关于碱金属单质的性质叙述错误的是( )| A. | 都能够在空气中燃烧 | B. | 都能够与水反应 | ||
| C. | 都是柔软的银白色金属(铯略带金色) | D. | 都可以保存在煤油中 |
分析 A.碱金属在空气中能燃烧;
B.碱金属属于活泼金属;
C.碱金属硬度较小,为银白色金属(铯略带金色);
D.Li的密度小于煤油.
解答 解:A.碱金属在空气中能燃烧生成氧化物、过氧化物和超氧化物等,即碱金属都能够在空气中燃烧,故A正确;
B.碱金属性质活泼,都能够置换水中的氢气,故B正确;
C.碱金属硬度较小,为银白色金属(铯略带金色),即碱金属都是柔软的银白色金属(铯略带金色),故C正确;
D.Li的密度小于煤油,Li不能保存在煤油中,其它的碱金属可以保存在煤油中,故D错误;
故选D.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的相似性和递变规律是解题的关键,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
16.下列图示操作正确的是( )
| A. | 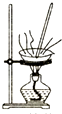 灼烧 | B. | 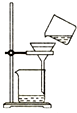 过滤 | ||
| C. | 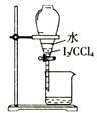 分液 | D. | 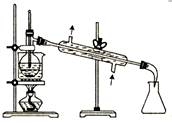 蒸馏 |
17.下列叙述正确的是( )
| A. | 蚕丝、棉花和人造丝的主要成分都是纤维素 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物,能发生水解反应 | |
| C. | “地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
11.下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
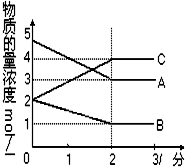 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.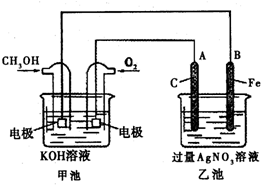 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
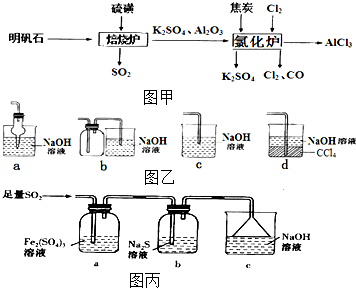 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲: