题目内容
18.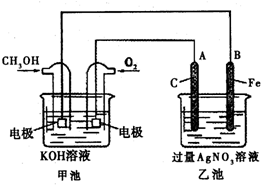 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O 请填空:
(1)充电时:①原电池的负极与电源负极相连 ②阳极的电极反应为4OH--4e-═2H2O+O2↑;
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O233.6L(标准状况下);
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为2Al+6H20$\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑.
分析 (1)充电时,原电池负极与电源负极相连,阳极上失电子发生氧化反应;
(2)乙池中B极上银离子得电子发生还原反应,根据转移电子相等计算氧气的体积;
(3)电解制备Al(OH)3时,Al为阳极,阴极生成氢气和氢氧根离子.
解答 解:(1)①充电时,原电池负极与电源负极相连,阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-═2H2O+O2↑,
故答案为:负;4OH--4e-═2H2O+O2↑;
(2)乙池中B极上银离子得电子发生还原反应,当乙池中B极的质量升高648g,则甲池中理论上消耗O2体积=$\frac{\frac{648g}{108g/mol}×1}{4}$=33.6L,
故答案为:33.6;
(3)电解制备Al(OH)3时,Al为阳极,阴极生成氢气和氢氧根离子,电解方程式为2Al+6H20 $\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑,
故答案为:2Al+6H20 $\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析、计算能力的考查,注意电极反应式的书写要结合电解质溶液的酸碱性,串联电路中转移电子相等.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
8.下列各组物质中,分类完全正确的一组是( )
| A酸 | B碱 | C盐 | D氧化物 |
| H2SO4 | Ba(OH)2 | H2S | H2O2 |
| NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
| HNO3 | NaOH | CaCO3 | CuO |
| HCl | Na2CO3 | CuSO4 | MnO2 |
| A. | A | B. | B | C. | C | D. | D |
9.既能和氢气发生加成反应,又能和卤素发生取代反应,又能被酸性高锰酸钾溶液氧化的烃是( )
| A. | 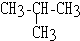 | B. | CH2=CH2 | C. | 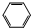 | D. | 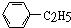 |
6.关于碱金属单质的性质叙述错误的是( )
| A. | 都能够在空气中燃烧 | B. | 都能够与水反应 | ||
| C. | 都是柔软的银白色金属(铯略带金色) | D. | 都可以保存在煤油中 |
13.下列说法中正确的是( )
| A. | 元素周期表的七个周期永远不会改变 | |
| B. | 元素周期表有九个横行,分为七个周期 | |
| C. | 元素周期表有十八个纵行,分为十六个族 | |
| D. | 元素周期表有十八个纵行,分为十八个族 |
3.下列电解质溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
10.下列鉴别方法可行的是( )
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用Ba( NO3)2溶液鉴别Cl-、$SO_4^{2-}$和$CO_3^{2-}$ | |
| C. | 用核磁共振氢谱鉴别l-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO |
7.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 离子化合物可能含共价键,共价化合物中不含离子键 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
6.用所学化学知识判断下列研究成果或报道可能不属实的是( )
| A. | 某山区发现了一种“柴油树”,它产生的树油可替代柴油使用 | |
| B. | 新型材料碳纳米管的化学性质常温下很稳定 | |
| C. | 美国最新研制出一种燃料电池,其能量转化率很高,可能达到100% | |
| D. | 蜘蛛丝(主要成分是蛋白质分子)强度特别大,可以用来制造防弹衣和降落伞绳 |