题目内容
14.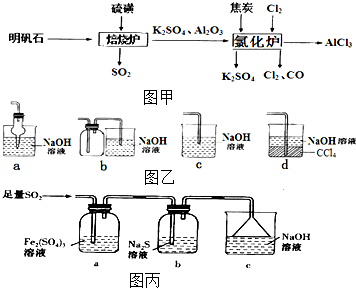 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:(1)验证焙烧炉产生的气体为SO2的方法是将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2.
(2)吸收焙烧炉中产生的SO2,如图乙装置合理的是ad(填代号).
(3)高温下氯化炉中发生反应的化学方程式为3C+Al2O3+3Cl2 $\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3.
(4)某学习小组设计用如图丙装置验证二氧化硫的某些化学性质.
①写出a瓶中发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②充分反应后,取a瓶中的溶液分成三份,分别进行如下实验.
实验Ⅰ:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验Ⅱ:向第二份溶液中加入少量KMnO4(H2SO4酸化)溶液,紫色褪去
实验Ⅲ:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明SO2具有还原性的是Ⅰ和Ⅱ(填实验代号).请根据所选实验的现象写出对应的化学反应方程式Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3、5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
分析 (1)用品红溶液检验二氧化硫;
(2)根据装置能否防止溶液倒吸分析解答;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO;
(4)①二氧化硫能被硫酸铁溶液氧化,生成硫酸根离子和亚铁离子;
②实验Ⅰ中有氢氧化亚铁沉淀生成,实验Ⅱ中有亚铁离子生成,都说明二氧化硫将铁离子还成亚铁离子,说明二氧化硫具有还原性,
实验Ⅰ:亚铁离子与氢氧化钠生成氢氧化亚铁沉淀,氢氧化亚铁被空气氧化成氢氧化铁;
实验Ⅱ:亚铁离子与KMnO4(H2SO4酸化)溶液,发生氧化还原反应,高锰酸钾溶液褪色;
实验Ⅲ:硫酸根离子与氯化钡生成硫酸钡沉淀;
解答 解:(1)用品红溶液检验二氧化硫,具有二氧化硫的方法为:将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2,
故答案为:将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2;
(2)a.干燥管球形处容积较大,溶液倒吸后会于烧杯内的液体分离,由重力作用又回到烧杯内,可以防止倒吸,故a正确;
b.广口瓶中进气管长,出气管短,不能防止倒吸,应进气管短,故b错误;
c.导管直接伸入液面内,会发生倒吸危险,故c错误;
d.二氧化硫经过四氯化碳后,被氢氧化钠溶液吸收,可以防止倒吸,故d正确,
故选:ad;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO,反应方程式为:3C+Al2O3+3Cl2 $\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3,
故答案为:3C+Al2O3+3Cl2 $\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3;
(4)①二氧化硫能被硫酸铁溶液氧化,生成硫酸根离子和亚铁离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②实验Ⅰ中有氢氧化亚铁沉淀生成,实验Ⅱ中有亚铁离子生成,都说明二氧化硫将铁离子还成亚铁离子,说明二氧化硫具有还原性,所以实验Ⅰ和Ⅱ都说明二氧化硫具有还原性,
实验Ⅰ:亚铁离子与氢氧化钠生成氢氧化亚铁沉淀,氢氧化亚铁被空气氧化成氢氧化铁,反应的离子方程式为Fe2++2OH-=Fe(OH)2↓(1分)、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓,
实验Ⅱ:亚铁离子与KMnO4(H2SO4酸化)溶液,发生氧化还原反应,高锰酸钾溶液褪色,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:Ⅰ和Ⅱ;Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3、5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题考查化学与技术、铜的精炼、实验制备方案设计、原电池等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 都能够在空气中燃烧 | B. | 都能够与水反应 | ||
| C. | 都是柔软的银白色金属(铯略带金色) | D. | 都可以保存在煤油中 |
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 离子化合物可能含共价键,共价化合物中不含离子键 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点如表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,
根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
请回答下列问题:
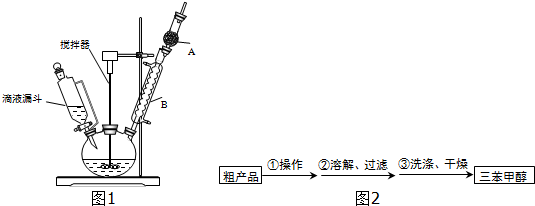
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如图2提纯方案:其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已经洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为KCl、Cl2;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是降温结晶.
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是$\frac{0.01}{3w}$mol•kg-1(以含w的代数式表示).
②学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,甲3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol.L-1的H2SO4,从发振荡 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:偏大,过量的I-会被空气中的O2氧化为I2.
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是Mg2+.
②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O.
| A. | 某山区发现了一种“柴油树”,它产生的树油可替代柴油使用 | |
| B. | 新型材料碳纳米管的化学性质常温下很稳定 | |
| C. | 美国最新研制出一种燃料电池,其能量转化率很高,可能达到100% | |
| D. | 蜘蛛丝(主要成分是蛋白质分子)强度特别大,可以用来制造防弹衣和降落伞绳 |
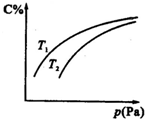 在密闭容器中,对于可逆反应A+3B?2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A+3B?2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )| A. | 若正反应方向△H<0,则T1>T2 | |
| B. | 压强增大时,混合气体的平均相对分子质量减小 | |
| C. | B一定为气体 | |
| D. | A一定为气体 |