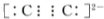题目内容
6.根据题意完成下列方程式(1)写出实验室制备氨气的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(2)写出实验室制备Cl2的离子方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;K2FeO4-Zn可组成碱电池,电池总反应式为:
2Fe O42-+8H2O+3Zn═2Fe(OH)3+3Zn(OH)2+4OH-.写出该电池的正极反应式FeO42-+3e-+4H2O=Fe(OH)3+5OH-.
分析 (1)氢氧化钙与氯化铵共热制取氨气、氯化钙和水;
(2)二氧化锰与浓盐酸反应制取氯气、氯化锰和水;
(3)FeCl3与KClO在强碱性条件下发生氧化还原反应生成高铁酸钾、氯化钾、和水,结合得失电子守恒写出方程式;K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料得电子生成氢氧化铁.
解答 解:(1)利用氢氧化钙与氯化铵共热制取氨气,该化学反应为Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$ CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(2)利用二氧化锰与浓盐酸反应制取氯气,该离子反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上K2FeO4得电子生成氢氧化铁,则正极的电极反应式为:FeO42-+3e-+4H2O=Fe(OH)3+5OH-;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;FeO42-+3e-+4H2O=Fe(OH)3+5OH-.
点评 本题考查了方程式的书写、原电池的工作原理的应用、电极反应式的书写等,题目难度中等,熟悉氧化还原反应的规律、原电池的工作原理是解题关键,注意培养阅读材料获取信息的能力.

| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
| A. | 实验室制备氢气 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | 铝粉与氧化铁粉末反应 |
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样.
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
| 离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
Ⅱ.消除氮氧化物和硫化物有多种方法.
【方法一】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3 产品的流程图如图(Ce为铈元素):
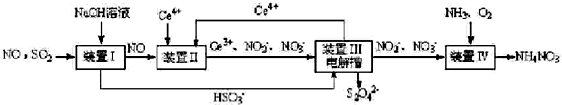
(2)装置Ⅰ中的主要反应的离子方程式为SO2+OH-=HSO3-.
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生12mol Ce4+.
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度2.0×10-7mol/L.(结果保留2位有效数字)
【方法二】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:
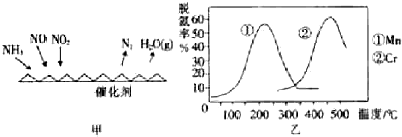
(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为Mn、200℃左右.
(6)用Fe做催化剂时,在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-4QkJ•mol-1.
【方法二】用活性炭还原法可以处理氮氧化物.
反应原理:1/2C(s)+NO(g)═1/2N2(g)+1/2CO2(g)△H=-QkJ/mol在T1℃时,反应进行到不同的时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L-1) | 0min | 10min | 20min | 30min | 40min | 50min |
| NO(mol/L-1) | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2.
| A. | 烧结粘土制陶瓷涉及化学变化 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒 |
①2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH
下列说法不正确的是( )
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO 是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol |
| 实验操作 | 现象 | 结论 | |
| A | 某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 有机物含碳碳双键 |
| B | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 常温下,将二氧化碳通入苯酚钠溶液 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 苯和苯酚稀溶液分别与浓溴水混合 | 后者产生白色沉淀 | 羟基影响了苯环的活性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 观察纺织品的吸水性 | B. | 测试纺织品的强度 | ||
| C. | 观察纺织品的燃烧的火焰、灰烬 | D. | 测试纺织品的保暖性 |