题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
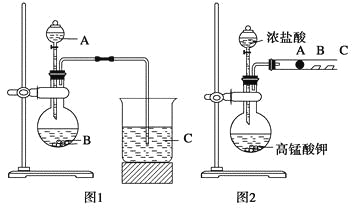
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为______________________________________________;
________________________________________________________________________。
(2)乙同学的实验原理是________________________________________________。
写出B处的离子方程式: _________________________________________________。
【答案】强酸制弱酸 稀硝酸 碳酸钙 硅酸钠溶液 CaCO3+2H+=Ca2++2CO2↑+H2O SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- 强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质 2I-+Cl2=2Cl-+I2
【解析】
非金属性的强弱可以根据最高价氧化物的水化物的酸性强弱判断,而酸性的强弱可以根据强酸制弱酸判断。非金属性的强弱也可以用单质的氧化性强弱判断,非金属单质的氧化性可以通过非金属单质间的置换反应判断。
(1)要想证明酸性强弱,能利用强酸制弱酸的依据。三种元素对应的酸为硝酸,碳酸,硅酸,所以应用稀硝酸和碳酸钙反应生成碳酸,即二氧化碳,二氧化碳和硅酸盐反应生成硅酸。反应的离子方程式为:CaCO3+2H+=Ca2++2CO2↑+H2O, SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(2)卤素单质的性质的氧化性依次减弱,利用强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质。用氯气和溴化钠反应生成氯化钠和溴,氯气和碘化钾反应生成氯化钾和碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2。