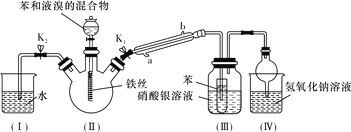
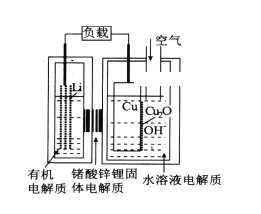
题目内容
【题目】短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
【答案】D
【解析】
R的简单氢化物可用作制冷剂,常见制冷剂为液氨,则R为N元素;X是短周期中金属性最强的元素,则X为Na元素;Y离子在同周期元素简单离子半径中最小,因Y的原子序数大于X,则Y为第三周期元素,第三周期元素形成的简单离子中,铝离子半径最小,则Y是Al元素;由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生,则黄色沉淀为S,则由W、X和Z三种元素形成的一种盐为Na2S2O3,刺激性气体为SO2,则W为O元素,Z为S元素。
综上,R、W、X、Y、Z分别为N、O、Na、Al、S。
根据以上分析,R、W、X、Y、Z分别为N、O、Na、Al、S,
A项,根据元素周期律可知,同周期元素的原子半径随原子序数的递增而逐渐减小,同主族元素的原子半径随原子序数的递增而逐渐增大,因此原子半径:Na>Al>S>O,即X> Y> Z>W,故A项错误;
B项,非金属性:O>S,元素的非金属性越强,对应的氢化物越稳定,则H2O的稳定性强于H2S的稳定性,即Z的简单氢化物的热稳定性比W弱,故B项错误;
C项,Y的氧化物是Al2O3,可溶于强酸和强碱溶液,R的最高价氧化物对应的水化物是硝酸,因硝酸是强酸,所以Al2O3可溶于硝酸中,R的氢化物是NH3,溶于水生成弱碱NH3![]() H2O,则Al2O3不能溶于NH3的水溶液中,故C项错误;
H2O,则Al2O3不能溶于NH3的水溶液中,故C项错误;
D项,X与W、Z形成的化合物有Na2SO3、Na2SO4、Na2S2O3、Na2S2O8等,故D项正确。
综上所述,本题正确答案为D。